Protein-Komplex: Bestimmung, Zusammensetzung, Struktur, Struktur, Funktionen, Klassifizierung und Charakterisierung. Was ist der Unterschied einfache Proteine aus komplexen?
Ein komplexes Protein, mit der Ausnahme der Protein-Komponente selbst umfasst eine zusätzliche Gruppe von einer anderen Natur (prothetischen). Als diese Komponente sind die Kohlenhydrate, Lipide, Metalle, Rückstände von Phosphor- säure, Nukleinsäure. Was ist der Unterschied einfache Proteine aus komplex ist, auf welche Arten von geteilten dieser Stoffe, und was sind ihre Eigenschaften, wird dieser Artikel sagen. Der Hauptunterschied zwischen den Substanzen in Frage – ihre Zusammensetzung.
Komplexe Proteine: Definition
Dieses Zwei-Komponenten-Material, die ein einfaches Protein (Peptid-Ketten) und nicht-proteinöse Material (prosthetische Gruppe) umfassen. Bei dem Verfahren der Hydrolyse werden die Aminosäuren gebildet werden, und Nicht-Protein-Anteil von Zersetzungsprodukten. Was ist der Unterschied einfache Proteine aus komplexen? Die erste besteht nur aus Aminosäuren.
Die Klassifizierung und Charakterisierung von komplexen Proteinen
Diese Stoffe werden in Typen unterteilt nach Art der zusätzlichen Gruppen abhängig. Für komplexe Proteine umfassen:
- Glykoproteine – Proteine, Moleküle enthalten, von denen ein Kohlenhydratrest. Unter ihnen sind Proteoglykane (Komponenten Interzellularraum), auch in seiner Struktur Mucopolysaccharide. Für Immunglobuline sind Glykoproteine.
- Lipoproteine enthalten eine Lipidkomponente. Dazu gehören Apolipoproteine, die die Funktion der Sicherstellung der Lipidtransport.
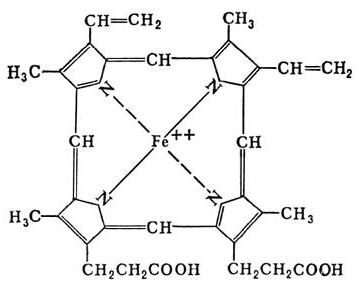
- Metalloproteine enthalten Metallionen (Kupfer, Mangan, Eisen, etc.) über eine Donor-Akzeptor-Wechselwirkung verbunden sind. Diese Gruppe umfasst nicht Hämproteine profirinovogo Ringverbindung mit Eisen umfasst, und dergleichen auf der Struktur der Verbindung (Chlorophyll, insbesondere).
- Nukleoproteine – Proteine nicht-kovalente Bindungen mit Nukleinsäuren mit (DNA, RNA). Dazu gehören Chromatin – die Komponente der Chromosomen.
- 5. Fosfoproteidy, die Casein (komplexen Proteinquark) umfasst kovalent gebundene Reste von Phosphorsäure umfassen.
- Chromoproteinen Färbung vereint die Prothesenkomponente. Diese Klasse umfasst Häm-Proteine, Chlorophylle und flavoproteins.
Merkmale von Glykoproteinen und Proteoglykanen
Diese Proteine sind komplexe Substanzen. Proteoglykane einen hohen Anteil an Kohlehydraten enthalten (80-85%), konventionelles Glycoprotein-Gehalt ist 15-20%. Uronsäuren im Molekül Proteoglykane nur vorhanden sind, Kohlenhydrate unterscheiden sich in ihrer regelmäßigen Struktur wiederkehrende Einheiten. Was ist die Struktur und Funktion von komplexen Proteinen, Glykoproteinen? Ihre Kohlenhydratketten sind nur 15 Einheiten und haben eine unregelmäßige Struktur. Die Kohlenhydratstrukturen von Glykoproteinen Kommunikation mit der Proteinkomponente ist typischerweise über Aminosäurereste wie Serin oder Asparagin.

Die Funktionen von Glykoproteinen:
- Sind Bestandteil der bakteriellen Zellwand, Knochen Bindegewebe und Knorpel, Kollagen umgeben die Fasern von Elastin.
- Spielt eine schützende Rolle. Zum Beispiel hat diese Struktur Antikörper, Interferone, Blutgerinnungsfaktoren (Prothrombin, Fibrinogen).
- Sind Rezeptoren, die mit dem Effektor interagieren – ein kleines Nicht-Protein-Molekül. Schließlich führt das Protein Beitritt zu einer Änderung ihrer Konformation, die zu einer spezifischen intrazellulären Reaktion führt.
- Führen Sie hormonelle Funktion. Es bezieht sich auf ein Glykoprotein-Gonadotropin, Schilddrüsen-stimulierendes Hormon und adrenocorticotropic.
- Substanz im Blut transportiert wird und die Ionen durch die Zellmembran (Transferrin, Transcortin, Albumin, Na +, K + -ATPase).
Durch Glycoprotein-Enzyme schließen Cholinesterase und Nuklease.
Mehr über Proteoglykane
Typischerweise Proteoglycan komplexes Protein enthält in seiner Struktur große Kohlenhydratkette mit sich wiederholenden Disaccharid-Resten, bestehend aus einer Uronsäure und Aminozucker. Oligo- oder Polysaccharid-Ketten genannt Glykane. Die erste enthält in der Regel 2-10 Monomereinheiten.
Je nach der Struktur der Kohlenhydratketten sezernieren ihre verschiedene Arten, beispielsweise saure Heteropolysaccharide mit mehr sauren Gruppen oder Glycosaminoglycan aminogruppenhaltigen. Zu letzteren gehören:
- Hyaluronsäure, die in der Kosmetik aktiv verwendet wird.
- Heparin, das die Blutgerinnung verhindert.
- Keratansulfat – Komponenten der Knorpel- und Hornhaut.
- Chondroitin Sulfate sind Teil des Knorpels und Synovialflüssigkeit.
Diese Polymere – Proteoglykan-Komponenten, die den interzellulären Raum zu füllen, behalten Wasser, Schmieren der beweglichen Teile der Gelenke, es ist ihre strukturellen Komponenten. Hydrophilie (gute Löslichkeit in Wasser) Proteoglykane erlaubt es ihnen, in den interzellulären Raum eine Barriere für große Moleküle und Mikroorganismen zu schaffen. Mit ihrer Hilfe schafft eine gelierte Matrix, in denen die Fasern eingetaucht andere wichtige Proteine, wie Kollagen. Seine Bands in Proteoglycan Umgebung haben eine Baumform.
Merkmale und Typen von Lipoproteinen
Lipoprotein-Komplex-Protein hat eine gut ausgeprägten Doppelhydrophiler und hydrophobe Natur. Das Kernmolekül (hydrophober Teil) einen unpolares Ester von Cholesterin und Triacylglyceriden bilden.
Außerhalb in der hydrophilen Zone angeordnet Proteinteil, Phospholipiden, Cholesterol. Es gibt mehrere Arten von Lipoproteinen Proteine auf ihrer Struktur abhängig.
Die Hauptklassen von Lipoproteinen:
- Hoch entwickelte Protein hoher Dichte (HDL, α-Lipoprotein). Verschiebt Cholesterol in die Leber und den peripheren Geweben.
- Niedrige Dichte (LDL, β-Lipoproteine). Neben Cholesterin Triacylglyceriden und Phospholipiden transportiert.
- Sehr geringer Dichte (VLDL, pre-β-Lipoprotein). Führen Sie eine ähnliche Funktion wie LDL.
- Chylomikronen (CM). Transportiert Fettsäuren und Cholesterin aus dem Darm nach der Nahrungsaufnahme.
Gefäßpathologie wie Arteriosklerose, ergibt mich aus unangebrachtem Verhältnis verschiedenen Typen von Lipoproteinen im Blut. Durch die Charakterisierung der Zusammensetzung kann mehrere Trends Phospholipiden Strukturänderung aufgedeckt werden (von HDL zu Chylomikronen): Verringerung des Anteils an Protein (80 bis 10%) und Phospholipide, Triacylglyceride prozentuale Zunahme (20 bis 90%).
Unter den vielen wichtigen Enzymen, Metalloproteinen
Metalloproteine können mehrere Metallionen umfassen. Ihre Anwesenheit wirkt sich auf die Orientierung des Substrates in den aktiven (katalytisch) Stelle des Enzyms. Metallionen ist in der aktiven Stelle und spielt eine wichtige Rolle in der katalytischen Reaktion entfernt. Ion wirkt oft als Elektronenakzeptor.
Beispiele für Metalle, in der Struktur des Enzyms Metalloproteine enthalten:
- Kupfer ist in der Cytochrom-Oxidase enthält, die zusammen mit Häm ein Ion dieses Metalls enthält. Das Enzym, das in der Bildung von ATP an der Atmungskette beteiligt.
- Eisen enthalten Enzyme, wie Ferritin, Eisen führt die Ablegefunktion in einer Zelle; Transferrin – ein Träger von Eisen im Blut; Katalase-Reaktion ist für die Neutralisierung von Wasserstoffperoxid verantwortlich.
- Zink – Metall, die für den Alkohol, die an der Oxidation von Ethanol und ähnliche Alkohole charakteristisch ist; Lactatdehydrogenase – ein Enzym in dem Stoffwechsel von Milchsäure; Carboanhydrase , welche die Bildung von Kohlensäure aus CO 2 katalysiert und H 2 O; alkalische Phosphatase, führt eine hydrolytische Spaltung von Phosphatestern mit verschiedenen Verbindungen; α2-Makroglobulin – antiproteazny Blutprotein.
- Selen ist ein Teil bei der Bildung der Schilddrüsenhormone Thyroperoxidase teilnehmen; Glutathion-Peroxidase, als Antioxidans wirkenden Funktion.
- Calcium ist charakteristisch für die Struktur der α-Amylase – Hydrolase-Spaltstärke.
Phosphoprotein
Der Teil des komplexen Protein Phosphoprotein? Für diese Kategorie durch das Vorhandensein der Phosphatgruppe aus, die an die Proteingruppe über eine Aminosäure mit einer Hydroxylgruppe (Tyrosin, Serin oder Threonin) verbunden ist. Was bedeutet Phosphorsäure, während in der Struktur eines Proteins? Es verändert die molekulare Struktur, eine Ladung zu geben, erhöht die Löslichkeit, beeinflusst die Eigenschaften des Proteins. Beispiele hierfür sind die Phosphoprotein Kasein und Eialbumin Milch, vor allem aber in die Kategorie der komplexen Proteine sind Enzyme.
Phosphatgruppe spielt eine wichtige funktionelle Rolle, da viele Proteine, die mit nicht dauerhaft ist. Im Käfig alle Prozesse die Zeit und -dephosphorylierung auftreten. Als Ergebnis wird die Verordnung in den Proteinen durchgeführt. Wenn beispielsweise die Histone – Proteine, Nukleinsäuren, verlaufen in dem phosphorylierten Zustand verknüpft ist, dann wird die Aktivität des Genoms (genetisches Material) zunimmt. Durch Phosphorylierung hängt von der Aktivität von Enzymen wie Glykogen-Synthase und Glycogenphosphorylase.
Nukleoprotein
Nukleoproteine – Proteine an Nukleinsäuren gebunden. Sie sind – ein integraler Teil des Speichers und Regulierung von genetischem Material, die Arbeit der Ribosomen, die Funktion des Ausführen Proteinsynthese. Die einfachste Form des Virus kann das Leben Ribo- und dezoksiribonukleoproteinami genannt werden, da sie von genetischem Material und Proteinen bestehen.
Da die Wechselwirkung von Desoxyribonukleinsäure (DNA) und Histon? In Chromatin isoliert zwei Arten von Proteinen , die mit DNA (Histon – und Nicht-Histon). Der erste Schritt bei der anfänglichen Verdichtung von DNA beteiligt. Nukleinsäuremolekül ist um Proteine verdrillt Nukleosomen zu bilden. Der gebildete Faden ist ähnlich wie die Kügelchen sind, gebildet supercoiled Struktur (chromatin Fibrillen) und supercoil (genonema Interphase). Durch die Wirkung von Histon-Proteine und Proteine mit höheren Ebenen bietet sie eine Verringerung der DNA Dimensionen tausendfach. Es ist ausreichend, um die Größe des Chromosoms und die Nukleinsäurelänge zu vergleichen, die Bedeutung von Proteinen (6-9 cm und 6,10 Mikrometer sind) zu beurteilen.
Was sind Chromoproteinen
Chromoproteinen enthält sehr unterschiedliche Gruppen, die nur durch eine Sache vereint sind – das Vorhandensein von Farbe in der prothetischen Komponente. Komplexe Proteine in dieser Kategorie sind unterteilt in: Hämoproteine retinalproteiny (Vitamin A), Flavoproteinen (Vitamin B2), kobamidproteiny (Vitamin B12) (Häm-Struktur enthalten).
Hämoproteine klassifiziert entsprechend den Funktionen auf einer nicht enzymatischen (mioglobinovy Hämoglobin und Protein) und Enzyme (Cytochrome, Katalasen, Peroxidasen).
Flavoproteine enthält als prothetische Komponente Derivate von Vitamin B2, Flavinmononucleotid (FMN) oder Flavin-Adenin-Dinukleotid (FAD). Diese Enzyme werden auch in Redox-Transformationen beteiligt. Dazu gehören Oxidoreduktasen.
Was ist Cytochrome?
Wie oben beschrieben wurde, besteht es aus Häm Porphyrin. Seine Struktur besteht aus vier Pyrrolringen, und ein zweiwertigen Eisen. Eine spezielle Gruppe von Häm – Enzyme – Cytochrome, die sich in der Aminosäurezusammensetzung und die Anzahl der Peptidketten, spezialisiert auf die Redox – Reaktion durchgeführt wird , durch die durch Elektronenübertragung vorgesehen ist , in der Atmungskette. Diese Enzyme sind in der mikrosomalen Oxidation beteiligt – ersten Reaktionen von xenobiotischen Biotransformation, was zu ihrer Clearance und Metabolismus vieler endogene und exogene Substanzen, wie Steroiden, gesättigten Fettsäuren.
Wirkung prothetische Gruppe
Prosthetische Gruppe, die ein Teil des komplexen Proteins beeinflusst seine Eigenschaften: seine Ladung, Löslichkeit, thermoplasticity verändern. Zum Beispiel ist eine solche Wirkung haben die Phosphorsäurereste oder Monosaccharide. Der Kohlenhydratanteil in dem Komplex des Proteins enthalten, schützen sie vor Proteolyse (zerstört durch Hydrolyse) wirkt sich auf das Eindringen von Molekülen durch die Zellmembran, die die Sekretion und Sortierung. Die Lipideinheit erlaubt die Proteinkanäle für den Transport von schlecht wasserlöslichen (hydrophoben) Verbindungen zu schaffen.
Die Struktur und Funktion komplexer Proteine sind völlig abhängig von der prosthetischen Gruppe. Beispielsweise unter Verwendung von eisenhaltiger Häm in Hämoglobin Sauerstoff Bindung auftritt und Kohlendioxid. Aufgrund Nukleoproteine durch die Wechselwirkung von Histonen gebildeten, Protamine mit DNA oder RNA genetischem Material auftritt schützen, seine kompakte Lagerung, den Prozess der Proteinsynthese in der RNA-Bindung. Nukleoproteine genannte stabile Komplexe von Proteinen und Nukleinsäuren.
Abschluss
Somit haben komplexe Proteine, die eine große Vielzahl von Funktionen im Körper. Daher ist der Verbrauch von Makro- und Mikronährstoffen so wichtig für die Gesundheit. Metalle sind Bestandteil vieler Enzyme. die Biochemie, vor allem den Gesundheits- und Umweltaufenthaltsstatus zu kennen, können Sie den Modus der eigenen Leistung anzupassen. Zum Beispiel kann das isolierte Gebiet, durch einen Mangel eines Elements gekennzeichnet. Zu seinem weiteren Eintrag in der Nahrung in Form von Additiven ermöglicht den Mangel kompensieren.