Formel Ammoniak. Ammoniumhydroxid – wässriges Ammoniak
Ammoniak – Wasserstoff Nitrid – eine der wichtigsten Verbindungen von Stickstoff und Wasserstoff. Dieses Gas ohne Farbe, sondern mit stechendem Geruch. Die chemische Zusammensetzung spiegelt Ammoniak Formel – NH 3. Die Druckerhöhung oder Abnahme der Temperatur des Materials, führt zu seiner eine farblose Flüssigkeit zu werden. Ammoniakgas und seine Lösungen werden in der Industrie und in der Landwirtschaft weit verbreitet. Das Medikament wird 10% iges Ammoniumhydroxid verwendet – Ammoniak.
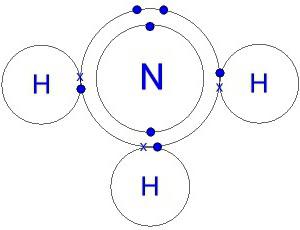
Die Struktur des Moleküls. Elektronische Ammoniak Formel
Ein Wasserstoffmolekül-Nitrid ist wie eine Pyramide geformt, deren Basis Stickstoff zu drei Wasserstoffatom gebunden ist. N-H-Bindung ist stark polarisiert. Stickstoff wird stark bindendes Elektronenpaar angezogen. Daher sammelt sich eine negative Ladung auf dem N-Atomen, die positiv – auf Wasserstoff konzentriert. Verständnis dieses Prozess stellt ein Modell des Moleküls, die elektronischen und Strukturformel von Ammoniak.
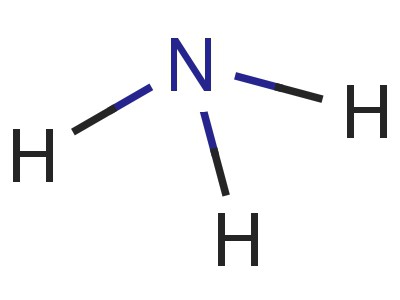
Nitride Wasserstoff ist in Wasser sehr löslich (700: 1 bei 20 ° C). im wesentlichen frei Protonen führt zur Bildung mehrerer Wasserstoff „Brücken“, die zwischen einem Molekül verbinden. Merkmale der Struktur und der chemischen Bindung auch auf die Tatsache, daß Ammoniak leicht durch Erhöhen des Drucks oder Absenken der Temperatur (-33 ° C) verflüssigt wird.

Herkunft des Namens
Der Begriff „Ammoniak“ wurde seit der Antike auf Anregung des russischen Chemikers Ya Zakharova, sondern Substanz vertraut für die Menschheit im Jahr 1801 an die akademischen Gemeinschaft eingeführt. Gas mit einem beißenden Geruch während des Zerfalls von Abfallprodukten von vielen organischen Verbindungen, zum Beispiel Proteinen und Harnstoff bei der Zersetzung von Ammoniumsalzen freigesetzt. Der Historiker der Chemie glaubt, dass der Stoff nach dem alten, ägyptischen Gott Amun benannt wurde. Siwa (Ammon) ist eine Oase in Nordafrika. Umgeben von der libyschen Wüste die Ruinen der antiken Stadt und dem Tempel, neben denen Ablagerungen von Ammoniumchlorid sind. Diese Substanz in Europa, genannt „Salz Ammon.“ Es bewahrt die Tradition, dass die Bewohner der Oase Siwa Salz im Tempel roch.
Hydrogen Nitrid
Englisch Chemiker und Physiker R. Boyle in Experimenten verbrannt Dung und beobachtet, um die Bildung von weißen Rauch aus den in Salzsäure getaucht Tupfer und die resultierenden in den Gasstrahl eingebracht. Im Jahr 1774, ein weiterer britischer Chemiker J. Priestley erwärmt Ammoniumchlorid mit gelöschtem Kalk und gasförmigen zuzugeordnet. Priestley genannte Verbindung „alkalische Luft“, weil seine Lösungseigenschaften zeigten eine schwache Base. Empfangene Erklärung Erfahrung Boyle, bei dem Ammoniak mit Salzsäure umgesetzt wird. Fester Ammoniumchlorid weiße tritt bei Kontakt der Reaktanden Moleküle in der Luft.
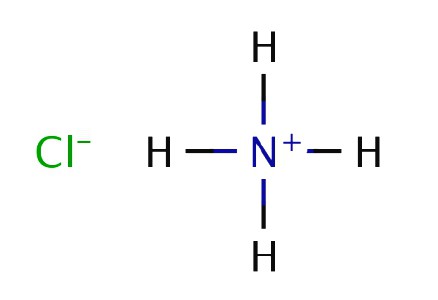
Chemische Formel von Ammoniak wurde bei 1875 K. Berthollets vom Franzosen gesetzt, die ein Experiment auf der Zersetzung von Substanzen in ihre Bestandteile durch die elektrische Entladung durchgeführt. Bisher Experimente Priestley, Boyle Berthollets und im Labor reproduzieren zu Wasserstoff Nitrid und Ammoniumchlorid herzustellen. Industrielles Verfahren 1901 von H. Le Chatelier entwickelt, erhielt ein Patent für ein Verfahren zur Synthese einer Substanz aus Stickstoff und Wasserstoff.
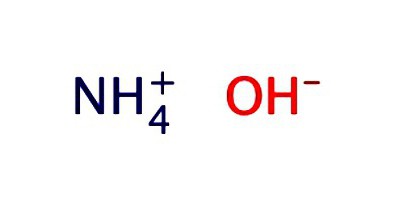
Eine Lösung von Ammoniak. Formel und Eigenschaften
NH 4 OH – die wässrige Ammoniaklösung wird in der Regel in Form von Hydroxid aufgezeichnet. Er weist die Eigenschaften eines schwach alkalischen:
- dissoziiert in Ionen NH 3 + H 2 O = NH 4 OH = NH 4 + + OH -;
- Phenolphthalein-Lösung färbt die purpurnen;
- wird mit einer Säure umgesetzt, um ein Salz und Wasser zu bilden;
- blaue Substanz ausfällt Cu (OH) 2 als helle , wenn sie mit löslichen Kupfersalzen vermischen.
Das Gleichgewicht in der Reaktion von Ammoniak mit Wasser Wechselwirkung wird in Richtung zu den Ausgangsmaterialien verdrängt. Vorgewärmten Wasserstoff Nitrid verbrennt auch in Sauerstoff. Es tritt Stickstoffoxidation zu zweiatomigen Molekülen einfache Substanz N2. Mindernden Eigenschaften zeigt auch Ammoniak bei der Reaktion mit Kupferoxid (II).

Bedeutung von Ammoniak und Lösungen
Nitride von Wasserstoff bei der Herstellung von Ammoniumsalzen und Salpetersäure verwendet, – eines der wichtigsten Produkte der chemischen Industrie. Ammoniak ist das Rohmaterial für Soda (als Nitrat-Methode). Wasserstoffgehalt Nitrid industriell konzentrierte Lösung 25% erreicht. In der Landwirtschaft verwendet werden wässeriges Ammoniak. Flüssigdünger Formel – NH 4 OH. Die Substanz wird als Top-Dressing direkt verwendet. Andere Verfahren zur Anreicherung Stickstoff Boden – die Verwendung von Salzen von Ammonium Nitrate, Chloride, Phosphate. In industriellen Umgebungen und auf landwirtschaftlichen Flächen ist es nicht mit Alkalien zusammen zu lagern Düngemittel Ammoniumsalze empfohlen. Beim Bruch Verpackungsmaterial miteinander reagieren kann, um Ammoniak zu bilden, und sie in die Lufträume freizugeben. Toxische Verbindung wirkt sich negativ auf die Atemwege, zentrales Nervensystem. Das Gemisch aus Ammoniak mit Luft, ist explosiv.

















