Ammoniakwasser: Erhalten, Formel Anwendung
Farblos Gas mit einem scharfen Geruch, Ammoniak NH 3 nicht nur in Wasser unter Wärmeentwicklung leicht löslich. Wirkstoff reagiert mit den Molekülen H 2 O ein schwaches Alkali zu bilden. Die Lösung hat mehrere Namen erhalten, einer von ihnen – Ammoniakwasser. Die Verbindung hat überraschende Eigenschaften, die in dem Prozess der Bildung, die Zusammensetzung und sind chemischer Reaktionen.
Ammoniumion Bildung
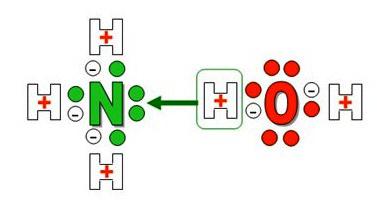 Ammoniakwasser Formel – NH 4 OH. Die Zusammensetzung der Materie vorhanden ist Kation NH 4 +, die Nichtmetalle gebildet wird – Stickstoff und Wasserstoff. N – Atome in dem Molekül Ammoniak wird verwendet zur Bildung der polaren kovalenten Bindungen aus 5 der äußeren Elektronen nur 3, und ein Paar nicht beanspruchten bleibt. Das stark polarisierte Wassermolekül Wasserstoffprotonen H + lose mit Sauerstoff gebunden ist , eine von ihnen wird ein Spender einsames Elektronenpaar des Stickstoffs (Akzeptor).
Ammoniakwasser Formel – NH 4 OH. Die Zusammensetzung der Materie vorhanden ist Kation NH 4 +, die Nichtmetalle gebildet wird – Stickstoff und Wasserstoff. N – Atome in dem Molekül Ammoniak wird verwendet zur Bildung der polaren kovalenten Bindungen aus 5 der äußeren Elektronen nur 3, und ein Paar nicht beanspruchten bleibt. Das stark polarisierte Wassermolekül Wasserstoffprotonen H + lose mit Sauerstoff gebunden ist , eine von ihnen wird ein Spender einsames Elektronenpaar des Stickstoffs (Akzeptor).
Donor-Akzeptor – ein Ammoniumion mit einer positiven Ladung und einer speziellen Art von schwachen kovalenten Bindung gebildet. Für seine Größe, Ladung und einige andere Features , die es ähnelt dem Kaliumkation und verhält sich wie ein Alkalimetall. Unusual hinsichtlich der chemischen Verbindung reagiert mit Säuren Salze sind von großer praktischer Bedeutung bilden. Namen, die die Merkmale und Eigenschaften der Materie widerspiegeln:
- Ammoniak-Wasser;
- Ammoniumhydroxid;
- Ammoniak-Hydrat;
- kaustisches Ammoniak.
Vorsorgemaßnahmen
Es muss darauf geachtet werden, wenn sie mit Ammoniak und seine Derivate arbeiten. Es ist wichtig, im Auge zu behalten:
- Ammoniakwasser hat einen unangenehmen Geruch. Das entweichende Gas reizt die Nasenschleimhaut Oberfläche des Auges, Husten verursachen.
- Bei der Lagerung von Ammoniak in einem losen verschlossenen Phiolen, Ampullen Ammoniak freigesetzt.
- Es kann ohne Instrumente erkannt wird, nur durch den Geruch auch eine geringe Menge an Gas in Lösung und Luft.
- Das Verhältnis zwischen den Molekülen und Kationen variiert bei verschiedenen pH in der Lösung.
- Mit einem Wert von etwa 7 , um die Konzentration von giftigem Gas verringert wird 3 NH Menge weniger schädlich für Organismen Kationen NH 4 + erhöht lebenden
Herstellung von Ammoniumhydroxid. physikalische Eigenschaften
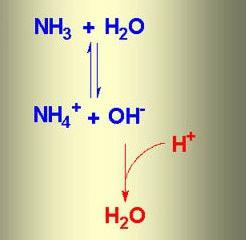
Wenn sie in Wasser gelöst ist, das gebildete Ammoniak Ammoniakwasser. Formel des Stoffes – NH 4 OH, aber in der Tat beide Ionen vorhanden sind ,
NH 4 +, OH -, Molekül von NH 3 und H 2 O. Der Ionenaustausch chemische Reaktion zwischen Ammoniak und Wasser, ein Gleichgewichtszustand. Der Prozess kann durch die Schaltung reflektiert werden, auf dem die entgegengesetzt gerichteten Pfeile, um die Reversibilität der Phänomene angeben.
Im Labor Herstellung von Ammoniakwasser wird in Experimenten mit stickstoffhaltigen Verbindungen durchgeführt. Wenn mit Ammoniakwasser gemischt, um eine klare, farblose Flüssigkeit zu ergeben. Bei hohen Drücken die Löslichkeit des Gases zunimmt. Wasser mehr darin sendet Ammoniak bei höheren Temperaturen gelöst. Für industrielle Zwecke und in der Landwirtschaft im industriellen Maßstab von 25 Prozent Substanz zu geben, wenn Ammoniak gelöst. Das zweite Verfahren verwendet die Reaktion von Koksofengas mit Wasser.
Die chemischen Eigenschaften von Ammoniumhydroxid
Wenn sie die beiden Flüssigkeiten kontaktieren – Ammoniakwasser und Salzsäure – werden von weißen Rauch Clubs abgedeckt. Es besteht aus Teilchen aus dem Reaktionsprodukt – Ammoniumchlorid. Mit solch einer flüchtigen Substanz, wie Salzsäure, erfolgt die Reaktion direkt in der Luft.

Low-Alkali Ammoniumhydroxid chemische Eigenschaften:
- Die Substanz dissoziiert reversibel in Wasser ein Ammoniumkation und ein Hydroxid-Ion zu bilden.
- In Gegenwart von NH 4 + -Ionen, die farblosen Lösung von Phenolphthalein in magenta Farbe gefärbt , wie in Laugen.
- Chemische Neutralisation mit Säure führt zur Bildung von Ammoniumsalzen und Wasser: NH 4 OH + HCl = NH 4 Cl + H 2 O.
- Ammoniakwasser treten in die Ionenaustauschreaktion mit den Metallsalzen, die auf die schwache Base entsprechen, wodurch ein wasserunlösliches Hydroxid bilden: 2NH 4 OH + CuCl 2 = 2NH 4 Cl + Cu (OH) 2 (blauer Niederschlag).
Ammoniakwasser: Anwendung in verschiedenen Bereichen der Wirtschaft
Ungewöhnliche Substanz wird im Alltag, in der Landwirtschaft, Medizin und Industrie weit verbreitet. Technisches Hydrat Ammoniak in der Landwirtschaft, Sodaasche, Farbstoffen und anderen Produkten verwendet. In dem Flüssigdünger enthält Stickstoff in Pflanzen leicht verdauliche Form. Der Stoff gilt als die billigste und effektivste für die Aufnahme in der Pre-Periode für alle Kulturen sein.

Für die Herstellung von Ammoniakwasser verbraucht dreimal weniger Mittel als in der Frage der festen körnigen Stickstoffdünger. Für die Lagerung und den Transport von Flüssigkeit aufgebracht hermetisch verschlossene Behälter aus Stahl sind. Einige Arten von Farben und Werkzeugen für Haarbleichmittel hergestellt unter Verwendung von Ammoniumhydroxid. In jeder medizinischen Einrichtung Zubereitungen mit Ammoniak – 10 Prozent Ammoniaklösung.
Ammoniumsalze: Eigenschaften und praktische Bedeutung

Substanzen, die durch Umsetzung von Ammoniumhydroxid mit Säuren hergestellt werden, sind in den Geschäftsaktivitäten verwendet. Salze zersetzen sich beim Erhitzen lösen sich in Wasser, unterzogen, um die Hydrolyse. Sie treten in chemische Reaktion mit Alkalien und anderen Substanzen. Der wichtigste praktische Wert erworben Chloride, Nitrate, Sulfate, Phosphate und Ammoniumcarbonat.
Es ist wichtig, die Regeln und Sicherheitsmaßnahmen, die Arbeit mit Stoffen zu folgen, die von Ammoniumionen bestehen. Wenn in den Lagern und kommerzielle landwirtschaftliche Betriebe gespeichert, landwirtschaftliche Betriebe müssen Kontakt dieser Verbindungen mit Alkalien und Kalk sein. Wenn dichte Pakete, die eine chemische Reaktion mit der Freisetzung von giftigem Gas beginnen. Jeder, der mit Ammoniakwasser und deren Salze arbeiten hat, müssen die Grundlagen der Chemie kennen. In Übereinstimmung mit den Sicherheitsanforderungen der verwendeten Materialien werden nicht Menschen Schaden zufügen oder die Umwelt.


















