Halogenierte Kohlenwasserstoffe: Herstellung, chemische Eigenschaften, Anwendung
Kohlenwasserstoffe sind eine sehr große Klasse von Verbindungen, die mit organischen Verbindungen zusammenhängen. Dazu gehören mehrere grundlegende Stoffgruppen, unter denen fast jeder eine breite Anwendung in der Industrie, im Leben, in der Natur findet. Von besonderer Bedeutung sind halogenierte Kohlenwasserstoffe, die im Artikel diskutiert werden. Sie sind nicht nur von hoher industrieller Bedeutung, sondern auch ein wichtiger Rohstoff für eine Vielzahl von chemischen Synthesen, die Herstellung von Arzneimitteln und anderen wichtigen Verbindungen. Besonderes Augenmerk legen wir auf die Struktur ihrer Moleküle, Eigenschaften und anderer Merkmale.

Halogenierte Kohlenwasserstoffe: allgemeine Eigenschaften
Unter dem Gesichtspunkt der chemischen Wissenschaft schließt diese Verbindungsklasse alle Kohlenwasserstoffe ein, in denen ein oder mehrere Wasserstoffatome durch ein oder anderes Halogen ersetzt sind. Dies ist eine sehr umfangreiche Kategorie von Stoffen, da sie von großer industrieller Bedeutung sind. Seit kurzem haben die Menschen gelernt, fast alle halogenierten Kohlenwasserstoffe zu synthetisieren, deren Verwendung in der Medizin, in der chemischen Industrie, in der Lebensmittelindustrie und im Alltag notwendig ist.
Die wichtigste Methode, diese Verbindungen zu erhalten, ist ein synthetischer Weg im Labor und in der Industrie, da praktisch keiner von ihnen in der Natur vorkommt. Aufgrund der Anwesenheit eines Halogenatoms weisen sie eine hohe Reaktivität auf. Dies bestimmt weitgehend den Bereich ihrer Anwendung in der chemischen Synthese als Zwischenprodukte.
Da Vertreter von halogenierten Kohlenwasserstoffen viel haben, ist es üblich, sie nach verschiedenen Merkmalen zu klassifizieren. Die Basis ist die Struktur der Kette und die Vielfalt der Bindung sowie der Unterschied in den Halogenatomen und die Lage ihrer Position.
Halogenierte Kohlenwasserstoffe: Klassifizierung
Die erste Trennungsmöglichkeit beruht auf allgemein anerkannten Grundsätzen, die für alle organischen Verbindungen gelten. Die Klassifizierung basiert auf dem Unterschied in der Art der Kohlenstoffkette, ihrer Zyklizität. Auf der Grundlage dieses Merkmals unterscheiden:
- Begrenzung halogenierter Kohlenwasserstoffe;
- Ungesättigt;
- Aromatisch;
- Aliphatisch;
- Azyklisch
Die nächste Teilung beruht auf der Form des Halogenatoms und seinem quantitativen Gehalt im Molekül. So unterscheiden sie:
- Mono-Derivate;
- Di-Derivate;
- Tri-;
- Tetra-;
- Penta-Derivate und so weiter
Wenn wir über die Form des Halogen sprechen, dann besteht der Name der Untergruppe aus zwei Wörtern. Zum Beispiel ein Monochlorderivat, ein Triiodderivat, ein Tetrabromhalogenalken und so weiter.
Es gibt auch eine andere Klassifizierungsoption, wonach die halogenierten Derivate der endgültigen Kohlenwasserstoffe abgetrennt werden. Dies ist die Zahl des Kohlenstoffatoms, an das das Halogen gebunden ist. So unterscheiden sie:
- Primäre Derivate;
- Sekundär;
- Tertiär und so weiter
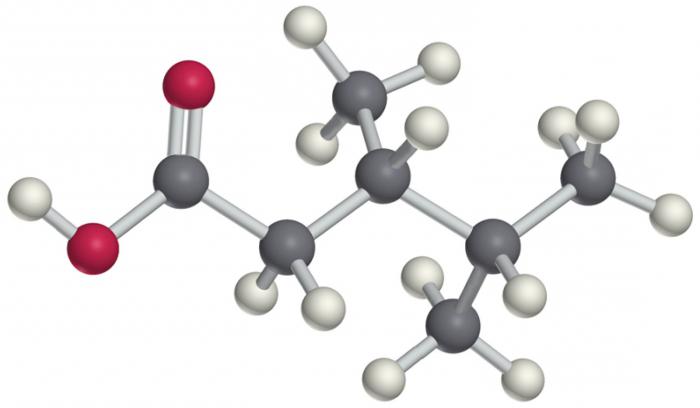
Jeder einzelne Vertreter kann von allen Merkmalen eingestuft werden und bestimmt den Gesamtplatz im System der organischen Verbindungen. So kann beispielsweise eine Verbindung mit der Zusammensetzung CH 3 -CH 2 -CH = CH-CCL 3 wie folgt klassifiziert werden. Dies ist ein ungesättigtes aliphatisches Trichlorderivat von Penten.
Die Struktur des Moleküls
Die Anwesenheit von Halogenatomen kann sowohl die physikalischen als auch die chemischen Eigenschaften und den allgemeinen Umriß der Struktur des Moleküls nicht beeinflussen. Die allgemeine Formel für diese Klasse von Verbindungen ist R-Hal, wobei R ein freier Kohlenwasserstoffrest einer beliebigen Struktur ist und Hal ein Halogenatom, ein oder mehrere ist. Die Bindung zwischen Kohlenstoff und Halogen ist stark polarisiert, so dass das Molekül als Ganzes anfällig für zwei Effekte ist:
- Negativ induktiv;
- Mesomere positiv
In diesem Fall wird der erste von ihnen viel stärker ausgedrückt, daher zeigt das Hal-Atom immer die Eigenschaften eines elektronenziehenden Substituenten.
Andernfalls unterscheiden sich alle Merkmale der Struktur des Moleküls nicht von denen der gewöhnlichen Kohlenwasserstoffe. Eigenschaften werden durch die Struktur der Kette und ihre Verzweigung, die Anzahl der Kohlenstoffatome, die Stärke der aromatischen Eigenschaften erklärt.
Die Nomenklatur der halogenierten Kohlenwasserstoffe verdient besondere Aufmerksamkeit. Wie korrekt sollten Sie diese Verbindungen nennen? Um dies zu tun, müssen Sie mehrere Regeln befolgen.
- Die Numerierung der Kette beginnt am Rand, an dem das Halogenatom näher liegt. Wenn es eine Mehrfachverbindung gibt, dann beginnt die Zählung genau damit und nicht mit dem elektronenziehenden Substituenten.
- Der Name Hal ist im Präfix angegeben, und die Nummer des Kohlenstoffatoms, von dem es abweicht, sollte ebenfalls angegeben werden.
- Der letzte Schritt gibt den Namen der Hauptkette der Atome (oder Ring).
Ein Beispiel für einen ähnlichen Namen: CH 2 = CH-CHCL 2-3-Dichlorpropen-1.
Der Name kann auch auf die rationale Nomenklatur gegeben werden. In diesem Fall wird der Name des Radikals ausgesprochen und dann das Halogen mit dem Suffix -id. Beispiel: CH 3 -CH 2 -CH 2 Br-Propylbromid.
Wie andere Klassen von organischen Verbindungen haben halogenierte Kohlenwasserstoffe eine besondere Struktur. Dies ermöglicht es vielen Vertretern, historisch geformte Namen zu benennen. Beispielsweise ist Fluorotan CF & sub3; CBrClH. Die Anwesenheit von drei Halogenen in der Zusammensetzung des Moleküls liefert dieser Substanz besondere Eigenschaften. Es wird in der Medizin verwendet, so wird es oft verwendet historisch geformten Namen.

Methoden der Synthese
Die Methoden zur Herstellung halogenierter Kohlenwasserstoffe sind sehr unterschiedlich. Es gibt fünf Hauptmethoden für die Synthese dieser Verbindungen im Labor und in der Industrie.
- Halogenierung von normalen Kohlenwasserstoffen mit normaler Struktur. Das allgemeine Reaktionsschema ist: RH + Hal2 → R-Hal + HHal. Die Besonderheiten des Verfahrens sind wie folgt: Chlor und Brom benötigen zwangsläufig eine Ultraviolettbestrahlung, bei Iod ist die Reaktion praktisch unmöglich oder sehr langsam. Mit Fluor ist die Wechselwirkung zu aktiv, so dass man dieses Halogen nicht in seiner reinen Form verwenden kann. Darüber hinaus erfordert die Halogenierung von aromatischen Derivaten die Verwendung von speziellen Katalysatoren des Lewis-Säureverfahrens. Zum Beispiel Eisen oder Aluminiumchlorid.
- Die Herstellung von halogenierten Kohlenwasserstoffen erfolgt ebenfalls durch Hydrohalogenierung. Allerdings muss die Ausgangsverbindung notwendigerweise ein ungesättigter Kohlenwasserstoff sein. Beispiel: R = RR + HHal → RR-RHal. Am häufigsten wird diese elektrophile Addition zur Herstellung von Chlorethylen oder Vinylchlorid verwendet, da diese Verbindung ein wichtiger Rohstoff für industrielle Synthesen ist.
- Die Wirkung von Hydrohalogen auf Alkohole. Allgemeine Ansicht der Reaktion: R-OH + HHal → R-Hal + H 2 O. Ein besonderes Merkmal ist die obligatorische Anwesenheit eines Katalysators. Beispiele für Prozessbeschleuniger, die verwendet werden können, sind: Phosphor, Schwefel, Zink oder Eisenchloride, Schwefelsäure, Zinkchloridlösung in Salzsäure – Lucas Reagenz.
- Decarboxylierung von Säuresalzen mit einem Oxidationsmittel. Ein anderer Name für die Methode ist die Borodin-Hunsdikker-Reaktion. Das Wesen liegt in der Abspaltung des Kohlendioxid-Moleküls aus Silber-Derivaten von Carbonsäuren unter Einwirkung eines Oxidationsmittel-Halogens. Als Ergebnis werden halogenierte Kohlenwasserstoffe gebildet. Die Reaktionen in der allgemeinen Form sehen so aus: R-COOAg + Hal → R-Hal + CO 2 + AgHal.
- Synthese von Haloformen. Mit anderen Worten, dies ist die Herstellung von trihalogenierten Methanderivaten. Der einfachste Weg, um sie herzustellen, ist, Acetal auf die Halogenlösung aufzutragen. Als Ergebnis werden Halogenmoleküle gebildet. Halogenderivate von aromatischen Kohlenwasserstoffen werden in gleicher Weise in der Industrie synthetisiert.
Besonderes Augenmerk sollte auf die Synthese von ungesättigten Vertretern der betreffenden Klasse gelegt werden. Die Hauptmethode ist die Wirkung auf Alkine von Salzen von Quecksilber und Kupfer in Gegenwart von Halogenen, die zur Bildung eines Produktes mit einer Doppelbindung in der Kette führen.
Halogenderivate von aromatischen Kohlenwasserstoffen werden durch Reaktionen der Halogenierung von Arenen oder Alkylarenen in der Seitenkette erhalten. Dies sind wichtige industrielle Produkte, da sie als Insektizide in der Landwirtschaft verwendet werden.
Physikalische Eigenschaften
Die physikalischen Eigenschaften von halogenierten Kohlenwasserstoffen hängen direkt von der Struktur des Moleküls ab. Nach dem Siedepunkt und dem Schmelzpunkt wird der Aggregatzustand durch die Anzahl der Kohlenstoffatome in der Kette und mögliche Zweige zur Seite beeinflusst. Je mehr von ihnen, desto höher die Zahlen. Im Allgemeinen können physikalische Parameter in mehreren Punkten charakterisiert werden.
- Aggregatzustand: die ersten unteren Vertreter – Gase, nach C 12 – Flüssigkeiten, höher – Feststoffe.
- Sie haben einen scharfen, unangenehmen, spezifischen Geruch, fast alle Vertreter.
- Sehr schlecht löslich in Wasser, aber selbst – ausgezeichnete Lösungsmittel. In organischen Verbindungen lösen sich sehr gut auf.
- Die Siede- und Schmelztemperaturen steigen mit der Anzahl der Kohlenstoffatome in der Hauptkette.
- Alle Verbindungen außer Fluorderivaten sind schwerer als Wasser.
- Je mehr Zweige in der Hauptkette, desto niedriger der Siedepunkt der Substanz.
Es ist schwierig, eine Menge ähnlicher Ähnlichkeiten zu identifizieren, weil die Vertreter in der Zusammensetzung und Struktur stark variieren. Daher ist es besser, Werte für jede einzelne Verbindung aus einer gegebenen Reihe von Kohlenwasserstoffen zu geben.
Chemische Eigenschaften
Einer der wichtigsten Parameter, die zwangsläufig in der chemischen Industrie und Synthese Reaktionen berücksichtigt werden, sind die chemischen Eigenschaften von halogenierten Kohlenwasserstoffen. Sie sind nicht das gleiche für alle Vertreter, da gibt es eine Reihe von Gründen für den Unterschied.
- Die Struktur der Kohlenstoffkette. Die einfachsten Substitutionsreaktionen (nucleophiler Typ) treten in sekundären und tertiären Halogenalkylen auf.
- Die Form des Halogenatoms ist ebenfalls wichtig. Die Bindung zwischen Kohlenstoff und Hal ist stark polarisiert, was einen leichten Bruch mit der Freisetzung von freien Radikalen ermöglicht. Allerdings ist die einfachste Verbindung genau zwischen Jod und Kohlenstoff, was durch eine natürliche Veränderung (Abnahme) der Bindungsenergie in der Reihe erklärt wird: F-Cl-Br-I.
- Die Anwesenheit eines aromatischen Radikals oder mehrfacher Bindungen.
- Die Struktur und Verzweigung des Radikals selbst.
Im Allgemeinen reagieren Halogenalkyle am ehesten spezifisch auf die nucleophile Substitution. Schließlich konzentriert sich eine teilweise positive Ladung auf das Kohlenstoffatom nach einer Störung der Bindung mit dem Halogen. Dies ermöglicht es dem Radikal als Ganzes, ein Akzeptor von Elektronen-negativen Partikeln zu werden. Zum Beispiel:
- OH – ;
- SO & sub4 ; 2- ;
- NO 2 – ;
- CN – und andere.
Dies erklärt die Tatsache, dass halogenierte Kohlenwasserstoffe in nahezu jede Klasse von organischen Verbindungen umgewandelt werden können, es ist nur notwendig, ein geeignetes Reagenz auszuwählen, das die gewünschte funktionelle Gruppe liefert.
Im Allgemeinen kann man sagen, dass die chemischen Eigenschaften von halogenierten Kohlenwasserstoffen die Fähigkeit sind, in die folgenden Wechselwirkungen einzutreten.
- Mit nukleophilen Partikeln verschiedener Art – Substitutionsreaktionen. Als Ergebnis können Alkohole, Ether und Ester, Nitroverbindungen, Amine, Nitrile, Carbonsäuren erhalten werden.
- Eliminierungs- oder Dehydrohalogenierungsreaktionen. Als Ergebnis der Wirkung einer Alkali- alkohol-Lösung wird das Halogenwasserstoff-Molekül abgespalten. So entsteht Alken, niedermolekulare Nebenprodukte – Salz und Wasser. Reaktionsbeispiel: CH 3 -CH 2 -CH 2 -CH 2 Br + NaOH (Alkohol) → CH 3 -CH 2 -CH = CH 2 + NaBr + H 2 O. Diese Prozesse sind eine der Hauptmethoden der Synthese wichtiger Alkene. Der Prozess wird immer von hohen Temperaturen begleitet.
- Vorbereitung von Alkanen einer Normalstruktur nach dem Würz-Syntheseverfahren. Das Wesen der Reaktion ist die Wirkung auf den halogensubstituierten Kohlenwasserstoff (zwei Moleküle) durch metallisches Natrium. Als hochelektropositives Ion akzeptiert Natrium Halogenatome aus der Verbindung. Als Ergebnis werden die freigesetzten Kohlenwasserstoffreste durch eine Bindung zusammengeschlossen, wobei ein Alkan einer neuen Struktur gebildet wird. Beispiel: CH 3 -CH 2 Cl + CH 3 -CH 2 Cl + 2Na → CH 3 -CH 2 -CH 2 -CH 3 + 2NaCl.
- Synthese von Homologen von aromatischen Kohlenwasserstoffen nach der Friedel-Crafts-Methode. Das Wesen des Verfahrens liegt in der Einwirkung von Benzol mit Halogenalkyl in Gegenwart von Aluminiumchlorid. Als Ergebnis der Substitutionsreaktion tritt die Bildung von Toluol und Chlorwasserstoff auf. In diesem Fall ist die Anwesenheit eines Katalysators erforderlich. Neben Benzol selbst ist es auch möglich, seine Homologen auf diese Weise zu oxidieren.
- Vorbereitung der Greniard-Flüssigkeit. Dieses Reagenz ist ein halogenierter Kohlenwasserstoff mit einem Magnesiumion in der Zusammensetzung. Zunächst wird Metallmagnesium im Ether dem Halogenalkylderivat ausgesetzt. Als Ergebnis wird eine komplexe Verbindung mit der allgemeinen Formel RMgHal, die als Grenyar-Reagens bezeichnet wird, gebildet.
- Reaktion der Reduktion auf Alkan (Alken, Aren). Unter der Einwirkung von Wasserstoff durchgeführt. Als Ergebnis wird ein Kohlenwasserstoff gebildet und ein Nebenprodukt, Halogenwasserstoff. Ein Beispiel in der allgemeinen Form: R-Hal + H 2 → RH + HHal.
Dies sind die Hauptinteraktionen, bei denen Halogenderivate von Kohlenwasserstoffen verschiedener Strukturen leicht eintreten können. Natürlich gibt es spezifische Reaktionen, die für jeden einzelnen Vertreter berücksichtigt werden sollten.
Isomerie der Moleküle
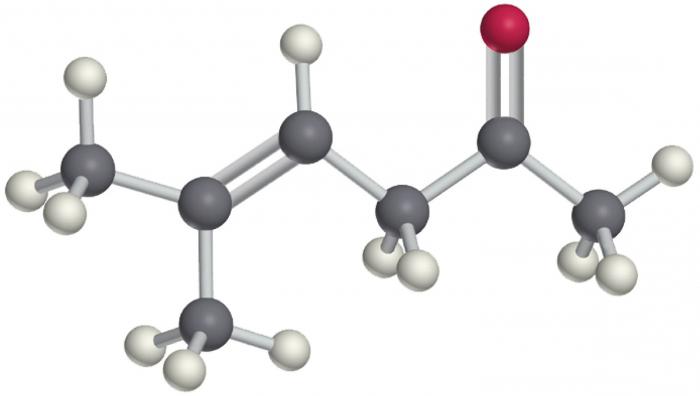
Die Isomerie der halogenierten Kohlenwasserstoffe ist ganz natürlich. Es ist bekannt, dass je mehr Kohlenstoffatome in der Kette, desto höher die Anzahl der isomeren Formen. Darüber hinaus haben ungesättigte Vertreter mehrere Bindungen, die auch das Auftreten von Isomeren verursachen.
Wir können zwei Hauptvielfalt dieses Phänomens für diese Klasse von Verbindungen unterscheiden.
- Isomerie des Kohlenstoffskeletts eines Radikals und eines Rückgrats. Dies schließt auch die Position der Mehrfachbindung ein, wenn sie im Molekül existiert. Wie bei einfachen Kohlenwasserstoffen, ausgehend von dem dritten Vertreter, ist es möglich, die Formeln von Verbindungen mit identischen molekularen, aber unterschiedlichen Strukturformelausdrücken aufzuschreiben. Darüber hinaus ist für halogenierte Kohlenwasserstoffe die Menge an isomeren Formen um eine Größenordnung höher als für die entsprechenden Alkane (Alkene, Alkine, Arene usw.).
- Die Position des Halogens im Molekül. Sein Platz im Titel ist durch eine Ziffer gekennzeichnet, und selbst wenn er sich nur um eins ändert, werden die Eigenschaften solcher Isomere ganz anders sein.
Es geht nicht um räumliche Isomerie, da Halogenatome dies unmöglich machen. Wie alle anderen organischen Verbindungen unterscheiden sich die Halogenalkylisomere nicht nur in der Struktur, sondern auch in ihren physikalischen und chemischen Eigenschaften.

Derivate von ungesättigten Kohlenwasserstoffen
Solche Verbindungen, natürlich, eine Menge. Allerdings sind wir daran interessiert, halogenierte ungesättigte Kohlenwasserstoffe. Sie können auch in drei Hauptgruppen unterteilt werden.
- Vinyl – wenn der Hal Atom, das direkt an der Kohlenstoffatom-Mehrfachbindung angeordnet ist. BEISPIEL Molekül: CH 2 = CCL 2.
- Mit einer isolierten Position. Das Halogenatom und die Mehrfachbindung in entgegengesetzten Teilen des Moleküls. Beispiel: CH 2 = CH-CH 2 -CH 2 -Cl.
- Allylderivate – ein Halogenatom der Doppelbindung durch ein Kohlenstoffatom angeordnet ist, ist, dass in der alpha-Position gespeichert. Beispiel: CH 2 = CH-CH 2 -Cl.
Von besonderer Bedeutung ist eine Verbindung , wie Vinylchlorid, CH 2 = CHCl. Es ist in der Lage Reaktionen Polymerisation wichtige Produkte, wie Isolierung, wasserdichtes Tuch und so weiter zu bilden.
Ein weiterer Vertreter der ungesättigten halogenierten Derivaten – Chloropren. Formel sein – SN₂ = CCL-CH = SN₂. Diese Verbindung ist ein Ausgangsmaterial für die Synthese von Kautschuken, die Feuerfestigkeit unterscheidet, lange Lebensdauer, geringe Durchlässigkeit für Gase.
Tetrafluorethylen (oder Teflon), – ein Polymer, das ein Qualitätsspezifikation hat. Es wird verwendet für die Herstellung von wertvoller Bedeckung der versicherungstechnischen Details, Geschirr, eine Vielzahl von Geräten. Formel – CF 2 = CF 2.
Aromatische Kohlenwasserstoffe und deren Derivate
Aromatische Verbindungen sind solche, die den Benzolring enthalten. Unter ihnen haben auch eine ganze Gruppe von Halogenen. Zwei Haupttypen von ihnen in der Struktur identifiziert werden.
- Wenn Hal Atom, das direkt an den Kern gebunden ist, das heißt den aromatischen Ring, dann ist die Verbindung Halogenarene genannt.
- Das Halogenatom nicht an den Ring und die Seitenkettenatom gebunden ist, das heißt einen Rest des Auslauf in den Seitenzweig. Solche Verbindungen sind Alkylhalogenide aryl genannt.
Zu den in Frage kommenden Substanzen können mehrere Mitglieder, von denen die größten praktischen Bedeutung genannt werden.
- Hexachlorbenzol – C 6 Cl 6. Seit Anfang des XX Jahrhunderts wurde als leistungsstarker Fungizid und Insektizid verwendet. Es hat eine gute desinfizierende Wirkung, so ist es für die Saatgutbehandlung vor den Vorführungen verwendet. Hat einen unangenehmen Geruch, genug Flüssigkeit ätzend, klar, kann Reißen verursachen.
- Benzylbromid C 6 H 5 CH 2 Br. Es wird als ein wichtiger Reaktant bei der Synthese von Organometallverbindungen verwendet.
- Chlorbenzol C 6 H 5 Cl ist . Farblos flüssige Substanz mit spezifischem Geruch. Verwendet bei der Herstellung von Farbstoffen, Pestiziden. Es ist eines der besten organischen Lösungsmitteln.

Einsatz in der Industrie
Halogenierte Kohlenwasserstoffe verwenden, um seine Industrie und die chemische Synthese ist sehr breit. Über ungesättigte und aromatische Vertreter gesagt. Nun bezeichnen im Allgemeinen die Verwendung der Verbindungen dieser Reihe.
- Im Aufbau.
- Als Lösungsmittel.
- Bei der Herstellung von Textilien, Gummi, Kautschuk, Farbstoffe, polymere Materialien.
- Für die Synthese vieler organischer Verbindungen.
- Fluorine-Derivate (FCKW) – ein Kältemittel in der Kältetechnik.
- Eingesetzt als Pestizide, Insektizide, Fungizide, Öle, Lacke, Harze, Schmiermittel.
- Zum Isoliermaterialien herzustellen, und so weiter.