Summen- und Strukturformel von Phenol
Phenole – der gemeinsame Name der aromatischen Alkohole. Auf den Eigenschaften der Materie sind schwache Säuren. Eine wichtige praktische Bedeutung sind viele Homologe Hydroxybenzol C 6 H 5 0H (Formel Phenol) – einfachste Vertreter der Klasse. Schauen wir uns dies genauer.
Phenole. Die allgemeine Formel und Klassifikation
Die allgemeine Formel der organischen Substanzen von aromatischen Alkoholen, – R-OH. Molekül selbst Phenole und Kresole gebildet Radikal – C6H5 Phenyl, das direkt mit einem oder mehreren Hydroxylgruppen verbunden ist OH (Hydroxyl-Gruppen). Durch ihre Zahl pro Molekül Phenole sind in ein-, zwei- und mehrwertigen klassifiziert. Einwertige Verbindungen dieser Art sind Phenol und Kresol. Die am häufigsten bei mehrwertigen Hydroxybenzole – Naphthole, die in ihrer Zusammensetzung 2 fusionierten Zellkern enthalten.
Phenol – der Vertreter von aromatischen Alkoholen
Textilarbeiter Phenol wurde bereits im XVIII Jahrhundert bekannt: die Weber nutzte es als Farbstoff. Bei der Destillation von Kohlenteer im Jahr 1834 in Deutschland, der Chemiker F. Runge hervorgehoben Kristalle der Substanz mit einem charakteristischen süßen Geruch. Der lateinische Name Kohle – carbo, so Verbindung genannt Karbolsäure (Karbolsäure). Deutsch-Forscher haben es versäumt, die Substanz zu identifizieren. Phenol Molekularformel wurde 1842 O. Laurent gegründet, der Karbol-Derivat von Benzol angenommen. Für die neue Säure verwendet, um den Namen „Phenyl“. Sharl Zherar bestimmt, dass die Substanz Alkohol ist, und es bezeichnet ein Phenol. Erstanträge Verbindung – Medizin, Gerben von Leder, Herstellung von synthetischen Farbstoffen. Eigenschaften des Stoffes unter Berücksichtigung:
- Rational chemische Formel – C 6 H 5 OH.
- Das Molekulargewicht der Verbindung – und 94.11. e. m.
- Die Bruttoformel des Aggregats, – C 6 H 6 O.

Elektronische und räumliche Struktur eines Moleküls von Phenol
Zyklische Struktur der Benzolformel von deutschem Bio-Chemiker F. Kekulé im Jahr 1865 angeboten, und kurz bevor es – I. Loschmidtsche. Wissenschaftler haben ein Molekül der organischen Substanz in der Form eines regelmäßigen Sechsecks mit Einfach- und Doppelbindungen abwechseln. Nach modernen Konzepten der aromatische Ring – eine besondere Art der kreisförmigen Struktur, „konjugierte Bindung“ bezeichnet.
Sechs Kohlenstoffatomen Prüfprozess sp 2 -Hybridisierung Elektronen – Orbitale. Nicht in der Bildung von C-C-Bindungen der Wolken p-Elektronen beteiligt oberhalb und unterhalb der Ebene des Moleküls Kerns überlappt. Es gibt zwei üblichen Elektronenwolken, die den ganzen Ring erstreckt. Phenol Strukturformel kann abweichen, da der historische Ansatz zur Beschreibung der Struktur von Benzol. die abwechselnd mit drei einfachen, um den Charakter der ungesättigten aromatischen Kohlenwasserstoffe zu betonen, üblicherweise drei der sechs Doppelbindungen berücksichtigt.
Polarisation aufgrund Oxygruppe
Im einfachsten aromatischen Kohlenwasserstoff – benzol, C 6 H 6 – Elektronenwolke ist symmetrisch. phenol Formel unterscheidet sich durch eine Hydroxygruppe. Die Gegenwart von Hydroxyl bricht die Symmetrie, die in den Eigenschaften des Stoffes reflektiert wird. Das Verhältnis zwischen Sauerstoff und Wasserstoff in einer Hydroxygruppe – polare kovalente. Offset gemeinsames Elektronenpaar an das Sauerstoffatom führt zu einer negativen Ladung darauf (teilweise). Wasserstoff verliert Elektronen und erwirbt eine Teilladung „+“. Darüber hinaus ist der Sauerstoff in der O-H-Gruppe die Besitzer von zwei ungeteilten Elektronenpaaren. Einer von ihnen durch die Elektronenwolke des aromatischen Rings angezogen. Aus diesem Grunde wird die Kommunikation polarisierter, Wasserstoff leicht ersetzt Metalle. Die Modelle geben eine Vorstellung von der asymmetrischen Natur des Phenol-Moleküls.
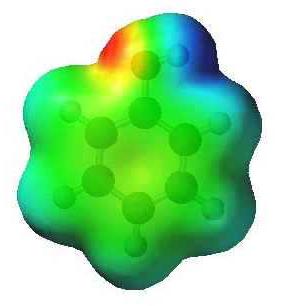
Eigenschaften Interferenz Atome in Phenol
Eine Elektronenwolke des aromatischen Kerns in Phenolmolekül reagiert mit einer Hydroxylgruppe. Es tritt Phänomen, conjugation Namen, in denen ein Sauerstoffatom eigenes Paar von Elektronen zu den Hydroxygruppen von einem Benzolringsystem angezogen. Die Verringerung der negativen Ladung durch eine größere Polarisations kompensiert aufgrund O-H-Gruppe.
Der aromatische Ring kann auch variiert elektronisches Verteilungssystem. Es wird durch den Kohlenstoff reduziert, der an Sauerstoff gebunden ist, und an den am nächsten dazu Atom in den ortho-Positionen erhöht (2 und 6). Paarung ist die Ansammlung von Ladung auf sich „-“. Weitere „shift Dichte – seine Bewegung von den Atomen an den meta-Positionen (3 und 5) an Kohlenstoff in der para-Position (4). phenol Formel für die Bequemlichkeit der Schnittstellenbildung und Interferenz enthält typischerweise numeratsiyu Atome des Benzolrings.
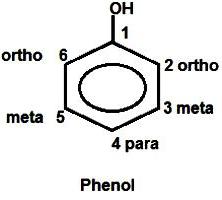
Erläuterung Phenol chemische Eigenschaften auf der Grundlage ihrer elektronischen Struktur
Verarbeitet Konjugation des aromatischen Rings und Hydroxyl beeinflussen die Eigenschaften beider Teilchen und alle Substanzen. Zum Beispiel an dem Atom mit einer hohen Elektronendichte in der ortho- und para-Positionen (2, 4, 6) macht die C-H-Bindung eines aromatischen Phenol Zyklus reaktiveren. Reduziertes negative Ladung der Kohlenstoffatom in meta-Position (3 und 5). Angriff von elektro Partikeln in chemischen Reaktionen ausgesetzt Kohlenstoff in der ortho- und para-Positionen. Die Bromierungsreaktion von Benzol Veränderungen tritt bei starken Erwärmung und die Anwesenheit eines Katalysators. Gebildet monogalogenoproizvodnoe – brombenzol. Formel phenol ermöglicht Substanz mit Brom zu reagieren, im Wesentlichen sofort, ohne die Mischung erhitzt wird.
Aromatischen Ring beeinflußt die Anschlusspolarität Hydroxygruppe, Erhöhen es. Wasserstoff wird flexibler, als zu gesättigten Alkoholen verglichen. Phenol reagiert mit Alkalien, Salze bilden – Phenolate. Ethanol reagiert nicht mit Alkali, oder besser gesagt, die Reaktionsprodukte – Ethanolate – zersetzen. Chemisch gesehen Phenole – stärkere Säure als Alkohole.
Vertreter von aromatischen Alkoholen Klasse
Summenformel Homolog Phenol – Kresol (Methylphenol Hydroxytoluol) – C 7 H 8 O Substance in natürlichen Rohstoffen oft begleitet phenol, auch antiseptische Eigenschaften hat. Andere Homologe von Phenol:
- Catechol (1,2-Hydroxybenzol). Chemische Formeln – C 6 H 4 (OH) 2.
- Resorcin (1,3-Hydroxybenzol) – C 6 H 4 (OH) 2.
- Pyrogallol (1,2,3-Trihydroxybenzol) – C 6 H 3 (OH) 3.
- Naphthol. Substanz Molecular Formel – C 10 H 7 OH. Es wird bei der Herstellung von Farbstoffen, Arzneimitteln, aromatischen Verbindungen verwendet.
- Thymol (2-Isopropyl-5-methyl-phenol). Chemische Formeln – C 6 H 3 CH 3 (OH) (C 3 H 7). Wird in der synthetischen organischen Chemie und Medizin.
- Vanillin ausgenommen phenolische Atome enthält eine Ethergruppe und einem Aldehyd-Rest. Summenformel Verbindung – C 8 H 8 O 3. Vanillin ist weithin als ein künstliches Aroma verwendet.
Formel Reagens zum Nachweis von Phenolen
Qualitative Bestimmung von Phenol kann unter Verwendung von Brom durchgeführt werden. Als Ergebnis der die Substitutionsreaktion ein weißer Niederschlag Tribromphenol. Catechol (1,2-Hydroxybenzol) ist in der grünen Farbe in Gegenwart von gelöster Eisenchlorid gefärbt. Mit dem gleichen Reagenz reagiert Phenol und ein Triphenol gebildet wird eine violette Farbe. Qualitative Reaktion auf Resorcin – Auftreten von dunkelvioletter Farbe in Gegenwart von Eisen-III-Chlorid. Allmählich verwandelt sich die Farbe der Lösung schwarz. Die Formel des Reagens, das verwendet wird , um bestimmtes Phenol und dessen Homologe zu erkennen, – FeCl 3 (Eisenchlorid (III)).
Hydroxybenzol, Naphthol, Thymol – alle Phenole. Die allgemeine Formel der Substanz, die die Mitgliedschaft dieser Verbindungen zu der aromatischen Reihe zu bestimmen. Alle organischen Verbindungen , die in ihrer Formel Phenyl enthaltenden Rest C 6 H 5, mit denen die Hydroxy – Gruppen , die direkt miteinander verbunden sind besondere Eigenschaften aufweisen. Sie unterscheiden sich von Alkohol ist am besten sauren Natur zum Ausdruck gebracht. Im Vergleich mit Substanzen homologe Reihe Benzol, Phenole – mehr aktive chemische Verbindung.