Was ist Sauerstoff? Sauerstoffverbindungen
Sauerstoff (O) – nichtmetallische chemische Element aus der Gruppe 16 (VIa) des Periodensystems. Es ist ein farb-, geruchs- und geschmacksneutral Gas für lebende Organismen erforderlich – Tiere , die sie in wandeln Kohlendioxid, und Pflanzen , die CO 2 als Kohlenstoffquelle zu nutzen, und O 2 wird in die Atmosphäre zurückgeführt . Sauerstoff bildet eine Verbindung mit praktisch jedem anderen Elemente reagieren, und verdrängt die chemischen Elemente der Kommunikation miteinander. In vielen Fällen werden diese Prozesse durch die Freisetzung von Wärme und Licht begleitet. Die wichtigste Verbindung von Sauerstoff ist Wasser.

Geschichte der Entdeckung
1772 demonstrierte die schwedische Chemiker Carl Wilhelm Scheele , dass eine solche erste Sauerstoff durch Erhitzen Nitrat Empfangen Kaliumoxid, Quecksilber, sowie viele andere Substanzen. Unabhängig von ihm im Jahr 1774 entdeckte der englische Chemiker Dzhozef Pristli das chemische Element durch thermische Zersetzung von Quecksilberoxid und veröffentlichte seine Erkenntnisse im selben Jahr, drei Jahre vor Scheele Veröffentlichung. In den Jahren 1775-1780 interpretierten das Französisch Chemiker Antuan Lavuaze die Rolle des Sauerstoffs in der Atemluft und Brennen, die Phlogistontheorie verwerfen, die gemeinhin zu der Zeit akzeptiert. Es ist für seine Neigung festgestellt Säuren zu bilden, wenn sie mit verschiedenen Substanzen und genanntem oxygène Elemente kombiniert, das bedeutet im Griechischen „erzeugte Säure“.

Vorherrschen
Was ist Sauerstoff? Ein Anteil von 46% des Gewichts der Kruste, ist es das häufigste Element davon. Die Menge an Sauerstoff in der Atmosphäre 21% nach Volumen und das Gewicht der 89% in Meerwasser.
Das Gestein Element mit Metallen kombiniert und Nichtmetalle in Form von Oxiden, die sauer (zum Beispiel Schwefel, Kohlenstoff, Aluminium und Phosphor) oder basische (Salze von Calcium, Magnesium und Eisen) sind und als salzartige Verbindungen, die sich von der Säure als abgeleitet betrachtet werden kann, und basische Oxide, wie Sulfaten, Carbonaten, Silikaten, Phosphaten und Aluminaten. Obwohl sie sind zahlreich, aber diese Feststoffe können als Sauerstoffquellen nicht dienen, als Bindungsspaltung mit Metallelement Energieverbrauch zu Atomen.
Features
Wenn der Sauerstoff Temperatur unter -183 ° C, wird es blass blaue Flüssigkeit, und bei -218 ° C – fest. Reines O 2 ist 1,1 – mal schwerer als Luft.
Während Tiere und einige Bakterien verbrauchen Sauerstoff aus der Atmosphäre und recycelten Kohlendioxid, wohingegen in grünen Pflanze die Photosynthese in Gegenwart von Sonnenlicht absorbieren Kohlendioxid und Freisetzung freier Sauerstoff zu atmen. Im ganzen O 2 in der Atmosphäre wird durch die Photosynthese erzeugt.
Bei 20 ° C für etwa 3 Volumenteile Sauerstoff in 100 Teilen frischen Wasser gelöst, etwas weniger als – im Meerwasser. Es ist notwendig, für die Atmung von Fischen und anderen Meereslebewesen.
Natürlicher Sauerstoff ist eine Mischung aus drei stabilen Isotopen 16 OS (99.759%), 17 O (0,037%) und 18 OS (0,204%). Es gibt mehrere künstlich erzeugte radioaktive Isotope. Die meisten von ihnen sind langlebig ist 15 O (Halbwertszeit 124) , die für die Untersuchung Atmung bei Säugetieren verwendet wird.

allotrope
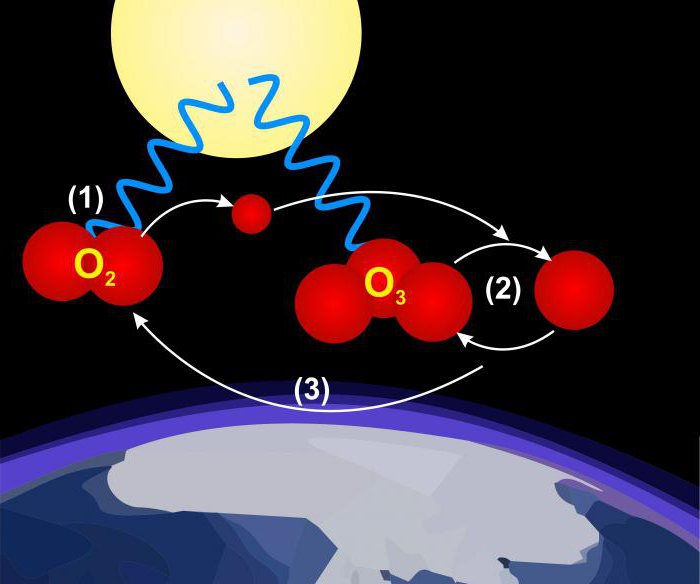
Eine klarere Vorstellung davon , welche Sauerstoff, ermöglichen ihren beiden allotropen Formen zu erhalten, zweiatomigen (O 2) und triatomic (O 3, Ozon). Eigenschaften zweiatomigen Form legen nahe, dass die sechs Elektronen binden Atom und zwei bleiben ungepaarte, wodurch den Paramagnetismus von Sauerstoff. Drei Atome Ozonmoleküle sind nicht auf einer Geraden liegen.
3O 2 → 2O 3: Ozon kann mit der Gleichung entsprechend hergestellt werden.
Der Prozess ist endotherm (Energie erfordert); Umwandlung von Ozon wieder in zweiatomigen Sauerstoff trägt zu der Anwesenheit von Übergangsmetallen oder deren Oxide. Reiner Sauerstoff wird durch die Wirkung eines elektrischen Glimmentladung in Ozon umgewandelt. Die Reaktion erfolgt auch bei Absorption von ultraviolettem Licht mit einer Wellenlänge von etwa 250 nm. Das Auftreten dieses Prozesses in der oberen Atmosphäre eliminiert Strahlung, die auf der Oberfläche der Erde schädlich für das Leben sein würde. Stechender Geruch von Ozon vorhanden ist innen mit einem Funken elektrischen Geräten wie Generatoren. Dieses Gas ist hellblau. Seine Dichte bei 1.658-mal größer ist als die Luft, und hat einen Siedepunkt von -112 ° C bei Atmosphärendruck.
Ozon – starke Oxidationsmittel zur Umwandlung von Schwefeldioxid, Schwefeltrioxid, Sulfid Sulfat, Jodid, Jods (analytisches Verfahren zur Beurteilung bereitstellt) sowie vielen sauerstoffhaltige organische Verbindung Derivate, wie Aldehyde und Säuren. Umwandlung von Kohlenwasserstoffen mit Ozon aus Autoabgasen in diesen Säuren und Aldehyde ist die Ursache von Smog. In der Industrie wird Ozon als chemisches Reaktionsmittel, Desinfektionsmittel für die Abwasserbehandlung, Wasserreinigung und Bleichen von Geweben verwendet.
Herstellungsverfahren
Verfahren zur Herstellung von Sauerstoff hängt davon ab, wie viel Gas erforderlich ist, zu erhalten. Labormethoden für die folgenden:
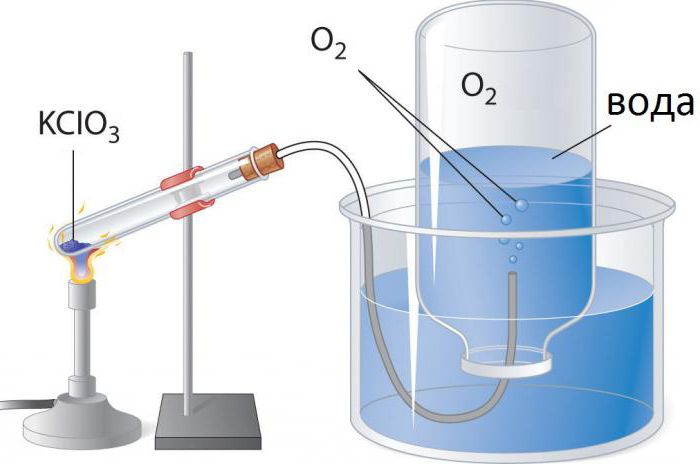
1. Thermische Zersetzung einiger Salze, wie Kaliumchlorat oder Kaliumnitrat:
- 2KClO 3 → 2KCl + 3O 2.
- 2KNO 3 → 2KNO 2 + O 2.
Kaliumchlorat Zersetzung von Übergangsmetalloxiden katalysiert. Für dieses häufig verwendet , Mangandioxid (Pyrolusit, MnO 2). Der Katalysator senkt die Temperatur für die Sauerstoffentwicklung erforderlich, 400-250 ° C
2. Degradation des Metalloxids unter der Wirkung der Temperatur:
- 2HgO → 2Hg + O 2.
- 2 Ag 2 O → 4Ag + O 2.
Scheele und Priestley für dieses chemische Element verwendeter Verbindung (Oxid), Sauerstoff und Quecksilber (II).
3. Die thermische Zersetzung des Metall Peroxide oder Wasserstoffperoxid:
- 2BaO + O 2 → 2BaO 2.
- 2 2BaO → 2BaO + O 2.
- BaO 2 + H 2 SO 4 → H 2 O 2 + BaSO 4.
- 2H 2 O 2 → 2H 2 O + O 2.
Die ersten industriellen Verfahren zur Abtrennung von Sauerstoff aus der Atmosphäre oder für die Herstellung von Wasserstoffperoxid, hängen von der Bildung eines Oxids von Bariumperoxid.
4. Die Elektrolyse von Wasser mit geringen Beimengungen von Salz oder Säuren , die Leitung des elektrischen Stroms zur Verfügung stellen:
2H 2 O → 2H 2 + O 2
Industrieproduktion
Falls notwendig, große Mengen an Sauerstoff zu erhalten, sind die fraktionierte Destillation der flüssigen Luft verwendet. Von den wichtigsten Komponenten der Luft hat es den höchsten Siedepunkt, und daher im Vergleich zu Stickstoff und weniger volatil Argon. Das Verfahren verwendet ein Kühlgas während seiner Expansion. Die wesentlichen Stufen des Betriebs wie folgt:
- Luft wird filtriert, um feste Teilchen zu entfernen;
- Feuchtigkeit und Kohlendioxid durch Absorption in Alkali entfernt werden;
- Luft wird komprimiert und die Kompressionswärme wird durch herkömmliche Verfahren entfernt Kühlung;
- dann tritt es in die Spule innerhalb der Kammer angeordnet ist;
- ein Teil des komprimierten Gases (bei einem Druck von etwa 200 atm) in der Kammer ausdehnt, Abkühlen der Spule;
- Gas kehrt zum Kompressor expandiert und strömt durch mehrere Stufen der Kompression und anschließende Expansion, wobei bei -196 ° C, die Luft wird Flüssigkeit;
- erhitztes flüssiges Destillations erstes Licht Inertgasen dann Stickstoff und flüssiger Sauerstoff verbleibt. Mehrere Fraktionierung produziert ausreichend rein ein Produkt (99,5%) für die meisten industriellen Anwendungen.
Einsatz in der Industrie
Metallurgie ist der größte Verbraucher von reinem Sauerstoff für die Herstellung von High-Carbon-Stahl: loszuwerden, die Kohlendioxid und anderen Verunreinigungen Nichtmetalle so schneller und einfacher als mit Luft.
Abwasser Sauerstoff Versprechen für ein effektivere Behandlung von flüssigem Abwasser als in anderen chemischen Prozessen. Es wird immer wichtiger in geschlossenen Abfallverbrennungsanlagen mit reinem O 2.
Die sogenannten Raketenoxidationsmittel sind flüssiger Sauerstoff. Reines O 2 Dies wird auf U – Boote und in der Taucherglocke verwendet.
In der chemischen Industrie, Sauerstoff ersetzt gewöhnliche Luft in der Herstellung von Substanzen wie Acetylen, Ethylenoxid und Methanol. Medizinische Anwendungen umfassen die Verwendung von Sauerstoffgas in den Kammern Inhalatoren und Säuglingsinkubatoren. Narkosegas mit Sauerstoff angereichert ist in der Lebens- Unterstützung während der Narkose. Ohne dieses chemische Element konnte eine Reihe von Branchen existieren, die Öfen verwenden. Das ist, was Sauerstoff.

Die chemischen Eigenschaften und Reaktion
Große Werte von Elektronenaffinität und Elektronegativität von Sauerstoff sind typische Komponenten, die metallische Eigenschaften aufweisen. Alle Verbindungen haben negativen Sauerstoffoxidationszustand. Wenn zwei Elektronenorbitale gefüllt, O 2- -Ion gebildet. Die Peroxide (O 2 2-) nimmt an, dass jedes Atom eine Ladung von -1 hat. Diese Eigenschaft der Elektronen, die durch eine vollständige oder teilweise Übertragung und bestimmt ein Oxidationsmittel zu akzeptieren. Wenn das Mittel mit der Substanz reagiert, Elektronendonor, verringert sich seine eigene Oxidationsstufe. Die Änderung (Abnahme) in der Sauerstoff der Oxidationsstufe von Null bis -2 Wiederherstellung bezeichnet.
Unter normalen Bedingungen bildet das Element eine zwei- und dreiwertige Verbindungen. Darüber hinaus gibt es extrem instabile Moleküle chetyrehatomnye. In zweiatomigen bilden zwei ungepaarte Elektronen auf den nichtbindender Orbitale entfernt. Dies wird durch Gas paramagnetisches Verhalten bestätigt.
Intensive Reaktivität erklärt manchmal Ozon Annahme, dass einer der drei Atome in der „atomic“ Zustand ist. Umsetzen dieses Atom aus der O 3, distanzierten molekularen Sauerstoff zu verlassen.
O 2 -Molekül bei normalen Temperaturen und Umgebungsdruck schwach reaktiv. Der atomare Sauerstoff ist viel aktiver. Die Dissoziationsenergie (O 2 → 2O) ist signifikant und 117,2 kcal mol.

Verbindungen
C eine solche Nichtmetalle wie Wasserstoff, Kohlenstoff, Schwefel, Sauerstoff, bildet eine Vielzahl von kovalent gebundenen Verbindungen, einschließlich Nichtmetalloxide , wie etwa Wasser (H 2 O), Schwefeldioxid (SO 2) und Kohlendioxid (CO 2); organische Verbindungen, wie Alkohole, Aldehyde und Carbonsäuren; gemeinsame Säuren wie Kohlensäure (H2 CO3), Schwefelsäure (H 2 SO 4) und Salpetersäure (HNO 3); und die entsprechenden Salze wie Natriumsulfat (Na 2 SO 4), Natriumcarbonat (Na 2 CO 3) und Natriumnitrat (NaNO 3). Sauerstoff in Form von O 2- -Ionen in der Kristallstruktur des festen Metalloxids, wie Verbindung (Oxid), Sauerstoff und CaO von Kalzium. Metall Superoxid (KO 2) enthalten Ionen O 2 -, während die Metallperoxide (BaO 2) enthalten Ionen O 2 2-. Sauerstoff-Verbindungen haben im allgemeinen eine Oxidationsstufe -2.
Schlüsseleigenschaften
Endlich haben wir die wichtigsten Eigenschaften von Sauerstoff Liste:
- Elektronenkonfiguration: 1s 2s 2 2 2p 4.
- Ordnungszahl: 8.
- Atommasse: 15,9994.
- Siedepunkt: -183,0 ° C
- Schmelzpunkt: -218,4 ° C.
- Dichte (wenn der Sauerstoffdruck von 1 atm bei 0 ° C): 1.429 g / l.
- Oxidationsstufe von -1, -2, +2 (in Verbindungen mit Fluor).