Die Molmasse von Sauerstoff. Was ist die Molmasse von Sauerstoff?
Atome der Elemente und Verbindungen Molekül vernachlässigbare Masse aufweisen. Zur Untersuchung der quantitativen Beziehungen, die spezifisch für chemische Reaktionen, mehr mit physikalischen Größen. Einer von ihnen – die Molmasse, die für die Atome, Ionen und Moleküle berechnet werden kann. Eines der wichtigsten Elemente auf der Erde – Sauerstoff, mit seiner Teilnahme auftreten, viele Reaktionen und Prozesse. Zur Durchführung der Berechnungen nach den Formeln der verwendeten Verbindungen Reaktionsgleichungen Molmasse von Sauerstoff, der an seinem relativen Gewicht eines Atoms oder Moleküls numerisch gleich ist.
Sauerstoff
Allgemeine Informationen über das Sauerstoff (chemisches Element)
- Lateinischer Name – Oxygenium;
- chemisches Symbol – O;
- in dem oberen Abschnitt 16 der ersten Gruppe gespeichert (vorher – Gruppe VI A) des Periodensystems;
- Es hat sich in der zweiten Periode unmittelbar nach der Stickstoff vor der Fluor;
- Er bezieht sich auf eine Familie Chalkogen;
- Elementzahl im Periodensystem und deren Ladung des Kerns der Atom – 8.
Sauerstoff ist eine der Komponenten der Atmosphäre für eine lange Zeit konnte nicht in reiner Form isoliert werden. Gas des „lebensspendend“, genannt „das Elixier des Lebens.“ Feiern Sie die Öffnung des Sauerstoffs zwischen den weltbekannten Wissenschaftlern geteilt: K. Scheele, J. Priestley, Antoine Lavoisier .. Der Begriff „Sauerstoff“ Lavoisier vorgeschlagen, bezogen auf die wichtige Rolle des Stoffes, dessen Atome in der Bildung von Oxiden und Säuren.

Wie die Molmasse zu finden ein Element oder Substanz?
Wenn chemische Berechnungen notwendig, die Masse in den Reaktionen von Atomen und Molekülen der Substanzen beteiligt wissen. Aber sie sind zu klein, was die Verwendung solcher Einheiten in Gramm und Kilogramm erschwert. Die Lösung wurde gefunden: angebotene andere Werte, die Berechnungen zu erleichtern. Zum Beispiel sind in der Chemie Werte relativ atomare und molekulare Masse. Die relative Atommasse (Ar) als die physikalische Größe ist in den 1961 Jahren eingeführt worden. Sein Wert ist auf 1/12 der Masse eines Kohlenstoffatom (das Isotop 12 C) gleich sind .
Zur Durchführung von Berechnungen von Formeln und Gleichungen mit der Verwendung dieser und anderer Werte unter Verwendung müssen einige Regeln beachten:
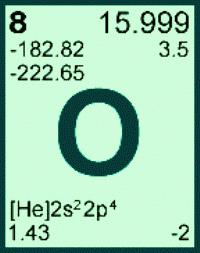
- Massen Atom im Periodensystem enthält neben chemischen Zeichen. Die Molmasse hat den gleichen Zahlenwert, aber mit den Einheiten g / mol.
- Gewicht von einem Mol der Substanz aus der Formel der Verbindung bestimmt sind, für die die Summe der molaren Masse aller Teilchen im Molekül.
- Wenn die chemische Formel ist, ein Index, der die Anzahl der Struktureinheiten anzeigt, ist es notwendig die Molmasse dieses Koeffizienten zu multiplizieren.
Atom- und Molekulargewicht des Sauerstoffs
Die Atommasse von Sauerstoff erhalten Ar (G) = 15.999 (in einem e m …): bezogen auf die Anzahl und die Verteilung der drei seiner natürlichen Isotopen. In den Berechnungen wird dieser Wert in der Regel abgerundet, dreht sich 16 für jedes Element sein Atomgewicht – konstant. Aus dem bekannten Gewicht der Atome des Elements mit der Ordnungszahl 8 kann durch die Molmasse von Sauerstoffelement zu finden. M (O) = 16. Eine andere dimensionslose physikalische Größe – das Molekulargewicht von Sauerstoff – bezieht sich auf eine einfache Substanz. Berechnen Sie die Masse des Sauerstoffmoleküls durch auf den stöchiometrischen Koeffizienten in der Formel das Gewicht eines Atoms Multiplikation: Mr (O 2) = Ar (G). 2 = 16. 2 = 32. In der Praxis ist es nicht erforderlich, was die Molmasse von Sauerstoff, um herauszufinden, da sein Wert auf das Gewicht der Moleküle der Substanz numerisch gleich ist, aber mit der Maßeinheit von g / mol. Für eine bestimmte Verbindung seines Molekulargewicht konstant ist, verwendet wird allgemein die Menge und die Masse der Substanz zu berechnen.

Stoffmenge
In der Chemie zur Vereinfachung der Berechnungen, verwendet es eine der wichtigsten physikalischen Größen – die Menge der Substanz. Er bezieht sich nicht auf das Gewicht, und die Anzahl der Struktureinheiten. Die Maßeinheit für die Menge an Substanz , die in dem Internationalen System (SI) erhielt 1 mol. Zu wissen , dass 1 mol enthält gleichen Teilchen wie in 12 g des Kohlenstoffisotops C 12 enthalten sind , können Anzahl der Atome, Moleküle, Ionen, Elektronen in dem Testabschnitt eines Stoffes enthalten sind, berechnet werden. Eine weitere Konstante wurde nach dem großen Wissenschaftler italienischer Avogadro (bezeichnet N A) benannt, ist sie die Anzahl der Strukturpartikel , die eine Substanzmenge enthält , wenn – 1 mol. Der Zahlenwert der Avogadro – Konstante – 6.02. 23. Oktober 1 / mol. Es ist die Anzahl von Atomen (Molekülen, Ionen) eine Molmasse aufweist. Bezeichnung der physikalischen Größe, – M-Einheit – 1 g / mol, für die Berechnungsformel – M = m / n (m – Gewicht (g), n – Stoffmenge (Mol)).
Was ist die Molmasse von Sauerstoff
In der Praxis gibt es keine Notwendigkeit, die Formel M = m / n zu verwenden, um die molare Masse von Sauerstoff zu berechnen. Bei der Lösung von Problemen erforderlich, um die meisten, um zu bestimmen, was die Masse ist, oder eine Reihe von Substanzen zu finden. Im ersten Fall wird für die Berechnung Formel m = n verwendet. M, in der zweiten – n = m / M. Der Zahlenwert der Molmasse gleich das Masseelement Atom und für den Stoff – Molekül. Beispielsweise ist die Masse von 16 g 1 Mol Sauerstoff Element. M (O 2) – die Molmasse des Sauerstoffmoleküls, das bis zu 32 g / Mol entspricht.
Die Molmasse Sauerstoffäquivalent
Genannt äquivalente Menge gleiches Gewicht an 1 Mol einwertiger Atom eines Elements. Im Allgemeinen kann das Äquivalentgewicht durch Dividieren den Molmasse von Atomen eines chemischen Elements an seiner Wertigkeit, die durch die Formel der jeweiligen Verbindung gefunden bestimmt werden. In den meisten seiner Sauerstoff – Verbindungen , wie chemisch-Chalkogen – Element ist zweiwertig. Molare Masse von Sauerstoff kann im Periodensystem, dessen gerundeter Wert gefunden werden – 16. Das Äquivalentgewicht von weniger als 2 mal – 8 Chemie anwendbaren Gesetz Äquivalente, die besagt , dass die Stoffe umgesetzt werden , zusammen in Mengen gleich ihren Äquivalenten. Bei der Durchführung von Berechnungen, um die äquivalenten Molmasse von Sauerstoff verwenden, um das Äquivalentgewicht der Substanz zu bestimmen, für die es nicht bekannt ist.

Sauerstoff – eines der wichtigsten Elemente in der Erdkruste, für 46,6% der Masse ausmachen. Eine einfache Verbindung mit dem gleichen Namen – die zweithäufigste in der Erdatmosphäre. Der Gehalt an molekularem Sauerstoff in der Luft – 20,947 Vol%. Mit Hilfe der Mitglieds Atomen und Molekülen auftreten viele Reaktionen und Prozesse in der Kunst, Industrie, organische und anorganische Natur. Es ist wichtig zu berücksichtigen, die quantitativen Verhältnisse in diesen Prozessen zu übernehmen, die stark die Verwendung von physikalischen Größen erleichtert, einschließlich Molmasse von Sauerstoff.