Chemische Eigenschaften von Alkinen Aufbau, Produktion, Anwendung
Alkane, Alkene, Alkine sind organische Chemikalien. Alle sind aus chemischen Elementen wie Kohlenstoff und Wasserstoff aufgebaut. Alkane, Alkene, Alkine sind chemische Verbindungen, die zu einer Gruppe von Kohlenwasserstoffen gehören.
In diesem Artikel werden wir uns die Alkine anschauen.
Was ist das?
Diese Substanzen werden auch als acetylenische Kohlenwasserstoffe bezeichnet. Die Struktur von Alkinen sorgt für die Anwesenheit von Kohlenstoff- und Wasserstoffatomen in ihren Molekülen. Die allgemeine Formel von Acetylen- Kohlenwasserstoffen ist: C n H 2n-2 . Das einfachste einfache Alkin ist Ethin (Acetylen). Er hat diese chemische Formel – C 2 H 2 . Auch Alkine schließen Propin mit der Formel C & sub3; H & sub4; ein. Zusätzlich wurden Butin (C 4 H 6 ), Pentin (C 5 H 8 ), Hexin (C 6 H 10 ), Heptin (C 7 H 12 ), Octin (C 8 H 14 ), Nonin ( C 9 H 16 ), Decin (C 10 H 18 ) usw. Alle Arten von Alkinen haben ähnliche Eigenschaften. Schauen wir sie genauer an. 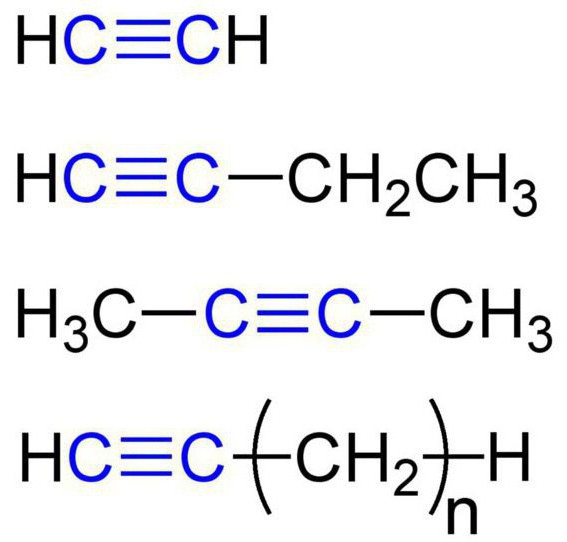
Physikalische Eigenschaften von Alkinen
Entsprechend ihren physikalischen Eigenschaften ähneln Acetylen-Kohlenwasserstoffe Alkenen.
Unter normalen Bedingungen haben Alkine, deren Moleküle zwei bis vier Kohlenstoffatome enthalten, einen gasförmigen Aggregatzustand. Diejenigen, in deren Molekülen gibt es von fünf bis 16 Kohlenstoffatomen, unter normalen Flüssigkeit Bedingungen. Diejenigen, deren Moleküle 17 oder mehr Atome dieses chemischen Elements enthalten, sind Feststoffe.
Alkine schmelzen und kochen bei einer höheren Temperatur als Alkane und Alkene.
Die Löslichkeit in Wasser ist unbedeutend, aber etwas höher als die von Alkenen und Alkanen.
Die Löslichkeit in organischen Lösungsmitteln ist hoch.
Das am weitesten verbreitete Alkin – Acetylen – hat solche physikalischen Eigenschaften:
- Hat keine farbe;
- Hat keinen riechen;
- Unter normalen Bedingungen befindet sich der gasförmige Aggregatzustand;
- Hat eine geringere Dichte als Luft;
- Der Siedepunkt beträgt minus 83,6 Grad Celsius;
Chemische Eigenschaften von Alkinen
In diesen Substanzen sind Atome durch eine Dreifachbindung verbunden, was ihre Grundeigenschaften erklärt. Alkine treten in Reaktionen dieser Art ein:
- Hydrierung;
- Hydrohalogenierung;
- Halogenierung;
- Hydratation;
- Brennen
Schauen wir sie in Ordnung an. 
Hydrierung
Die chemischen Eigenschaften von Alkinen erlauben ihnen, in Reaktionen dieser Art einzutreten. Dies ist eine Art chemische Wechselwirkung, bei der ein Molekül der Materie zusätzliche Atome von Wasserstoff zu sich selbst bringt. Hier ist ein Beispiel für eine solche chemische Reaktion im Falle von Propen:
2H & sub2; + C & sub3; H & sub4; = C & sub3; H & sub8;
Diese Reaktion erfolgt in zwei Stufen. Auf dem ersten Molekül von Propen fügt zwei Wasserstoffatome und das zweite – so viel hinzu.
Halogenierung
Dies ist eine weitere Reaktion, die Teil der chemischen Eigenschaften von Alkinen ist. Als Ergebnis bindet das Molekül des Acetylen-Kohlenwasserstoffs die Halogenatome an. Die letzteren umfassen Elemente wie Chlor, Brom, Iod usw.
Hier ist ein Beispiel für eine solche Reaktion im Falle von Ethyn:
C 2 H 2 + 2 CI 2 = C 2 H 2 CI 4
Das gleiche Verfahren ist mit anderen acetylenischen Kohlenwasserstoffen möglich.
Hydrohalogenierung
Dies ist auch eine der Hauptreaktionen, die Teil der chemischen Eigenschaften von Alkinen ist. Es besteht darin, daß die Substanz mit solchen Verbindungen wie HCl, HI, HBr usw. zusammenwirkt. Diese chemische Wechselwirkung erfolgt in zwei Stufen. Betrachten wir eine Reaktion dieser Art mit dem Beispiel von Ethin:
C & sub2; H & sub2; + HCI = C & sub2; H & sub3; CI
С 2 Н 2 СІ + НСІ = С 2 Н 4 СІ 2 
Hydratation
Dies ist eine chemische Reaktion, die in Wechselwirkung mit Wasser besteht. Es passiert auch in zwei Stufen. Betrachten wir es mit dem Beispiel von Ethyn:
H 2 O + C 2 H 2 = C 2 H 3 OH
Die Substanz, die nach der ersten Stufe der Reaktion gebildet wird, heißt Vinylalkohol.
Wegen der Tatsache, daß nach Eltekovs Regel die funktionelle Gruppe OH nicht neben der Doppelbindung liegen kann, gibt es eine Umlagerung der Atome, wodurch sich Acetaldehyd aus Vinylalkohol bildet.
Der Prozess der Hydratation von Alkinen wird auch die Reaktion von Kucherov genannt. 
Brennen
Dies ist der Prozess der Wechselwirkung von Alkinen mit Sauerstoff bei hoher Temperatur. Betrachten wir das Brennen von Substanzen dieser Gruppe mit dem Beispiel von Acetylen:
2C 2 H 2 + 2 O 2 = 2H 2 O + 3C + CO 2
Mit einem Überschuss an Sauerstoff verbrennen Acetylen und andere Alkine ohne Kohlenstoffbildung. Nur Kohlenmonoxid und Wasser werden freigesetzt. Hier ist die Gleichung einer solchen Reaktion mit Propen als Beispiel:
4O 2 + C 3 H 4 = 2H 2 O + 3 CO 2
Die Verbrennung von anderen Acetylen-Kohlenwasserstoffen erfolgt ebenfalls in ähnlicher Weise. Als Ergebnis werden Wasser und Kohlendioxid freigesetzt.
Andere Reaktionen
Auch Acetylene können mit Salzen solcher Metalle wie Silber, Kupfer, Kalzium reagieren. Gleichzeitig werden Wasserstoffatome durch Metallatome ersetzt. Betrachten wir diese Art von Reaktion im Beispiel mit Acetylen und Silbernitrat:
C 2 H 2 + 2 AgNO 3 = Ag 2 C 2 + 2 NH 4 NO 3 + 2H 2 O
Ein weiterer interessanter Prozess mit Alkinen ist die Reaktion von Zelinsky. Dies ist die Bildung von Benzol aus Acetylen, wenn es in Gegenwart von Aktivkohle auf 600 Grad Celsius erhitzt wird. Die Gleichung dieser Reaktion kann also ausgedrückt werden:
3C 2 H 2 = C 6 H 6
Es ist auch möglich, die Polymerisation von Alkinen – den Prozess der Kombination von mehreren Molekülen der Materie in einem Polymer. 
Empfangen
Alkine, die Reaktionen, mit denen wir oben diskutiert haben, werden im Labor durch mehrere Methoden erhalten.
Die erste ist Dehydrohalogenierung. Die Reaktionsgleichung sieht so aus:
C 2 H 4 Br 2 + 2 KOH = C 2 H 2 + 2 H 2 O + 2 KBr
Um ein solches Verfahren durchzuführen, ist es notwendig, die Reagenzien zu erwärmen und auch Ethanol als Katalysator zuzugeben.
Es ist auch möglich, Alkine aus anorganischen Verbindungen zu erhalten. Hier ist ein Beispiel:
CaC & sub2; + H & sub2; O = C & sub2; H & sub2; + 2 Ca (OH) & sub2;
Die nächste Methode zur Herstellung von Alkinen ist die Dehydrierung. Hier ist ein Beispiel für eine solche Reaktion:
2CH & sub4; = 3H & sub2; + C & sub2; H & sub2 ;.
Mit Hilfe dieser Art von Reaktion ist es möglich, nicht nur Ethin, sondern auch andere Acetylen-Kohlenwasserstoffe zu erhalten.

Die Verwendung von Alkinen
Die häufigste in der Industrie war die einfachste Alkin-Ethin. Es ist weit verbreitet in der chemischen Industrie verwendet.
- Sie benötigen Acetylen und andere Alkine, um sie aus anderen organischen Verbindungen wie Ketonen, Aldehyden, Lösungsmitteln usw. zu bekommen.
- Auch aus Alkinen können Substanzen gewonnen werden, die bei der Herstellung von Kautschuken, Polyvinylchlorid usw. verwendet werden.
- Von propinum ist es möglich, Aceton als Ergebnis von Kucherovs Bericht zu erhalten.
- Zusätzlich wird Acetylen bei der Herstellung von Chemikalien wie Essigsäure, aromatischen Kohlenwasserstoffen, Ethylalkohol verwendet.
- Ein weiteres Acetylen wird als Brennstoff mit einer sehr hohen Verbrennungswärme verwendet.
- Auch wird die Verbrennungsreaktion von Ethan zum Verschweißen von Metallen verwendet.
- Zusätzlich kann unter Verwendung von Acetylen ein technischer Kohlenstoff erhalten werden.
- Auch diese Substanz wird in geschlossenen Leuchten verwendet.
- Acetylen und eine Reihe anderer Kohlenwasserstoffe dieser Gruppe werden aufgrund ihrer hohen Verbrennungswärme als Raketentreibstoff eingesetzt .
Dies ist das Ende der Verwendung von Alkinen. 
Schlussfolgerung
Als letzter Teil geben wir einen kurzen Tisch über die Eigenschaften von acetylenischen Kohlenwasserstoffen und deren Herstellung.
| Name der Reaktion | Erläuterungen | Ein Beispiel für Gleichung |
| Halogenierung | Die Reaktion der Zugabe von Halogenatomen (Brom, Iod, Chlor usw.) zu einem Acetylen-Kohlenwasserstoff-Molekül | C & sub4; H & sub6; + 2 I & sub2; = C & sub4; H & sub6; I & sub2; |
| Hydrierung | Die Reaktion der Anlagerung von Alkinatomen an Wasserstoffatome. Es kommt in zwei Stufen vor. |
C & sub3; H & sub4; + H & sub2; = C & sub3; H & sub6; C & sub3; H & sub6; + H & sub2; = C & sub3; H & sub8; |
| Hydrohalogenierung | Die Reaktion der Zugabe von Hydrohalogen (HI, HCl, HBr) durch ein Acetylen-Kohlenwasserstoff-Molekül. Es kommt in zwei Stufen vor. |
C & sub2; H & sub2; + HI = C & sub2; H & sub3; I C & sub2; H & sub3; I + HI = C & sub2; H & sub4; I & sub2; |
| Hydratation | Eine Reaktion auf Wechselwirkung mit Wasser. Es kommt in zwei Stufen vor. |
C & sub2; H & sub2; + H & sub2; O = C & sub2; H & sub3; OH C & sub2; H & sub3; OH = CH & sub3; -CHO |
| Komplette Oxidation (Verbrennung) | Wechselwirkung von Acetylen-Kohlenwasserstoff mit Sauerstoff bei erhöhter Temperatur. Als Ergebnis werden Kohlenmonoxid und Wasser gebildet. |
2C2H5 + 5O2 = 2H2O + 4CO2 2C 2 H 2 + 2 O 2 = H 2 O + CO 2 + 3 C |
| Reaktionen mit Metallsalzen | Die Schlussfolgerung ist, dass die Metallatome die Wasserstoffatome in den Molekülen der Acetylenkohlenwasserstoffe ersetzen. |
C 2 H 2 + AgNO 3 = C 2 Ag 2 + 2 NH 4 NO 3 + 2H 2 O |
Alkine können in Laborbedingungen auf drei Arten gewonnen werden:
- Aus anorganischen Verbindungen;
- Durch Dehydrierung von organischen Stoffen;
- Verfahren zur Dehydrohalogenierung von organischen Stoffen
So untersuchten wir alle physikalischen und chemischen Eigenschaften von Alkinen, die Methoden ihrer Herstellung, das Anwendungsgebiet in der Industrie.