Was ist Protein? Beispiele für einfache und komplexe Proteine
Um zu verstehen, wie wichtig sind die Proteine, genügt es, die bekannte Phrase Fridriha Engelsa zu erinnern: „Das Leben – eine Möglichkeit der Existenz von Proteinkörpern“ In der Tat, kann in der Welt dieser Substanzen zusätzlich zu Nukleinsäuren, alle Erscheinungen der lebenden Materie. In diesem Artikel werden wir herausfinden, was es von Protein besteht, untersuchen, welche Funktion sie sowie definieren die Strukturmerkmale der verschiedenen Spezies führt.
Peptide – hoch organisierte Polymere
Tatsächlich in einer lebenden Zelle als pflanzliche und tierische Proteine quantitativ vorherrschend über die anderen organischen Substanzen, sowie die größte Anzahl von verschiedenen Funktionen arbeiten. Sie beteiligen sich an einer Vielzahl von sehr wichtige zelluläre Prozesse, wie Bewegung, Schutz, Alarmfunktion und so weiter. Zum Beispiel umfasst im Muskelgewebe von Tieren und Menschen Peptide bis zu 85 Gewichts-% Trockenmasse, und in Knochen und Dermis – 15-50%.
Alle Zell- und Gewebeproteine werden zusammengesetzt Aminosäuren (20 Typen). Ihre Zahl in lebende Organismen ist immer gleich zwanzig Arten. Verschiedene Kombinationen von Peptid-Monomere, die eine Vielzahl von Proteinen in der Natur zu bilden. Es ist die astronomische Zahl von 2×10 18 möglichen Arten geschätzt. In der Biochemie Polypeptide molekularen biologische Polymere genannt – Makromoleküle.
Aminosäuren – Protein Monomere
Alle 20 Arten dieser chemischen Verbindungen sind Proteine und Struktureinheiten der allgemeinen Formel NH 2 -R-COOH. Sie sind amphotere organische Substanzen, die sowohl basische als auch saure Eigenschaften auszuüben. Nicht nur einfache Proteine, sondern auch komplexe, enthalten sogenannte essentielle Aminosäuren. Aber die wesentlichen Monomere, wie Valin, Lysin, Methionin kann nur in bestimmten gefunden werden Arten von belkov.Takie Proteine als hochwertige bezeichnet.
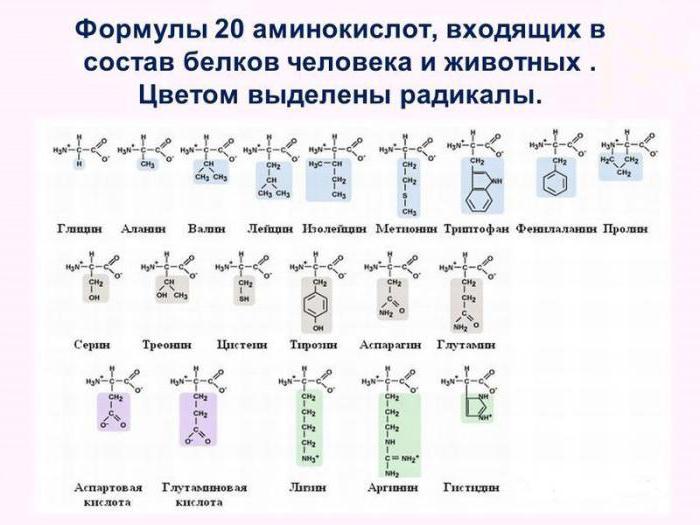
Daher wird das Polymer in Betracht Charakterisierung nicht nur, wie viele der Aminosäuren-Protein, sondern auch, welche Art von Monomeren sind, die durch Peptidbindungen in dem Makromolekül verbunden ist. Hinzufügen , dass nicht – essentielle Aminosäuren, wie Asparagin, Glutaminsäure, Cystein unabhängig in Zellen von Menschen und Tieren , synthetisiert werden können. Essentielle Monomere sind Proteine, die in Bakterien, Pflanzen und Pilzen hergestellt. Sie kommen in heterotrophen Organismen nur mit Lebensmitteln.
Wie hergestelltes Polypeptid
Wie bekannt ist, 20 verschiedene Aminosäuren können auf eine Vielzahl von Arten von Proteinmolekülen gekoppelt werden. Wie funktioniert die Bindung von Monomeren miteinander? Es scheint, daß die Carboxyl- und Aminogruppen benachbarter Aminosäuren liegen Interact. Eine sogenannte Peptidbindungen, und Wassermoleküle werden als Nebenprodukt der Polykondensationsreaktion zugeordnet. Das resultierende Protein-Molekül besteht aus Aminosäureresten und repetitive Peptidbindungen. Deshalb werden sie auch Polypeptide genannt.
Oft können Proteine enthalten nicht nur eine, sondern mehrere Polypeptidketten und bestehen aus vielen Tausenden von Aminosäureresten. Außerdem einfache Proteine und sind in der Lage, ihre räumliche Konfiguration Eiweiss kompliziert. Dies schafft nicht nur die primäre, sondern auch sekundäre, tertiäre und sogar Quartärstruktur. Lassen Sie uns diesen Prozess genauer untersuchen. Fortsetzung, die Frage zu untersuchen, was ein Protein bildet, herauszufinden, was die Konfiguration dieses Makromolekül hat. Wir haben herausgefunden, dass eine Polypeptidkette eine Vielzahl von kovalenten chemischen Bindungen umfasst. Es ist diese Struktur wird der primäre genannt.
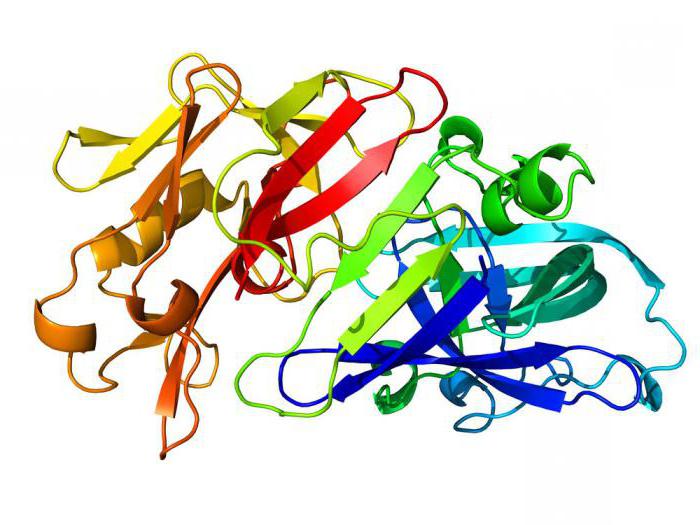
Es spielt eine wichtige Rolle, um die qualitative und quantitative Zusammensetzung von Aminosäuren, sowie die Reihenfolge ihrer Verbindung. Sekundärstruktur entsteht im Moment der Helix. Es stabilisiert viele neu entstehenden Wasserstoffbrücken.
Höhere Ebenen der Proteinorganisation
Tertiärstruktur ist ein Ergebnis Spirale in Form einer Kugel von Verpackungen – Kügelchen, beispielsweise Muskelprotein Myoglobin Stoff hat nur eine solche räumliche Struktur. Es unterstützt wird als neu durch Wasserstoffbindungen gebildet wird, und Disulfidbrücken (wenn mehrere Cysteinreste Proteinmolekül enthalten). Quaternäre Form – das ist das Ergebnis von neuen Arten von Wechselwirkungen, wie hydrophobe oder elektrostatische in eine einzige Struktur mehr Proteinkügelchen kombiniert. Zusammen mit den Peptiden und Quartärstruktur umfasst nicht-proteinartiges Teil. Diese können Magnesiumionen, Eisen, Kupfer oder Reste Orthophosphat oder Nukleinsäuren und Lipide.
Eigenschaften der Proteinbiosynthese
Wir haben bereits herausgefunden, was es von Protein besteht. Es ist aus Aminosäuresequenz eingebaut. Ihre Anordnung in eine Polypeptidkette erfolgt in der Ribosomen – Nichtmembranorganellen, Pflanzen- und Tierzellen. Bei der Biosynthese des Moleküls sind ebenfalls beteiligt Informationen und Transfer-RNA. Die erste ist eine Schablone für die Proteinanordnung und der zweiten verschiedene Aminosäuren vermitteln. ist, nämlich ein Dilemma, in dem Prozess der zellulären Biosynthese besteht Protein von Nukleotiden oder Aminosäuren? Die Antwort ist einfach – die Polypeptide sowohl einfache als auch komplexe bestehen aus amphoteren organischen Verbindungen – Aminosäuren. In dem Lebenszyklus von Zellen gibt es Perioden seiner Aktivität , wenn die Proteinsynthese besonders aktiv stattfindet. Diese Stufe J1 und J2 Interphase so genannte. Zu diesem Zeitpunkt wird die Zelle aktiv wachsende und braucht viel Baumaterial, das Protein ist. Ferner wurde als ein Ergebnis der mitotischen Ende bilden zwei Tochterzellen, von denen jede eine große Menge an organischen Substanzen, muss jedoch in den Kanälen glatten endoplasmatischen Retikulum ist aktiv Synthese von Lipiden und Kohlenhydraten, und in dem granulierten EPM auftritt Biosynthese von Proteinen. 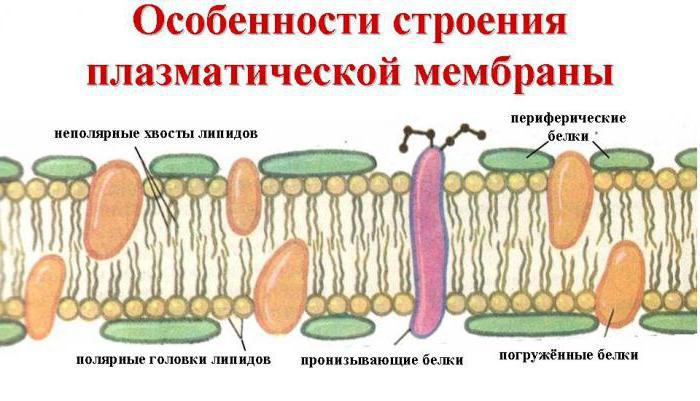
Die Funktionen von Proteinen
Zu wissen, was für ein Protein bildet, kann es als eine große Vielfalt von Arten erklärt werden, und den einzigartigen inhärenten Eigenschaften dieser Substanzen. Proteine führen in den Käfig eine Vielzahl von Funktionen, wie beispielsweise die Konstruktion, als Teil der Membranen aller Zellen und Organellen: Mitochondrien, Chloroplasten, Lysosomen, Golgi-Komplex, und so weiter. Solche Peptide wie gamoglobuliny oder Antikörper – sind Beispiele für einfache Proteine, die eine Schutzfunktion erfüllen. Mit anderen Worten, die zelluläre Immunität – das ist das Ergebnis der Wirkung dieser Substanzen. Ein komplexes Protein – keyhole, zusammen mit Hämoglobin, trägt Tiertransportfunktion aus, das heißt, führt Sauerstoff im Blut. Signalproteine, die die Zellmembran bilden, um die Zellstoffinformationen zur Verfügung stellen und versuchen, in ihrem Zytoplasma zu bekommen. Albumin Peptid ist verantwortlich für die Eckwerte des Blutes, zum Beispiel für seine Fähigkeit zu gerinnen. Protein Ovalbumin Lager der Eier in einen Käfig, und die wichtigste Quelle von Nährstoffen.

Proteine – die Basis der Zelle Zytoskeletts
Eine der wichtigsten Funktionen von Peptiden – Unterstützung. Es ist sehr wichtig, die Form und das Volumen von lebenden Zellen zu erhalten. Die so genannte Struktur submembrane – Mikrotubuli und Mikrofilamenten verflochten ein internes Skelett der Zellen zu bilden. Proteine, die in ihrer Zusammensetzung enthalten, z.B. Tubulin, können leicht zusammengedrückt und gestreckt werden. Dies hilft, die Zelle ihre Form in mechanischen Verformungen zu halten.
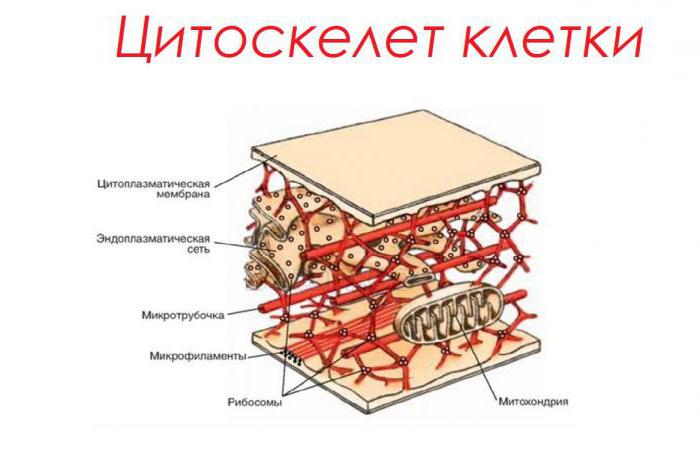
In Pflanzenzellen, zusammen mit Proteinen Hyaloplasma, stützende Funktion arbeitet auch Stränge Zytoplasma – plasmodesmata. Passieren durch die Poren in der Zellwand, die sie verursachen, die die Beziehung zwischen einer Anzahl von zugrunde liegenden zellulären Strukturen, die das Pflanzengewebe bilden.
Enzyme – eine Substanz, von Protein-Natur
Eine der wichtigsten Eigenschaften von Proteinen – ihre Wirkung auf die Geschwindigkeit chemischer Reaktionen. Basische Proteine sind in der Lage, teilweise zu denaturieren – Abwickelvorgang Makromolekül in tertiäre oder quaternäre Struktur. Die gleiche Polypeptidkette ist nicht gebrochen. Partielle Denaturierung unterliegt sowohl das Signal und die katalytische Funktion des Proteins. Die letztere Eigenschaft ist die Fähigkeit von Enzymen, um die Rate der biochemischen Reaktionen in dem Kern und im Zytoplasma von Zellen zu beeinflussen. Peptide, die umgekehrt die Geschwindigkeit der chemischen Prozesse reduziert nicht Enzyme und Inhibitoren bezeichnet. Zum Beispiel ist ein einfaches Protein Catalase ein Enzym, das die Spaltung von Wasserstoffperoxid von toxischen Substanzen beschleunigt. Es wird als das Endprodukt vielen chemischen Reaktionen erzeugt. Katalase beschleunigt ihr zur Verfügung stehenden neutralen Substanzen, Wasser und Sauerstoff.
Eigenschaften von Proteinen
Die Peptide werden in vielerlei Hinsicht klassifiziert. Zum Beispiel in Bezug auf Wasser in hydrophilen und hydrophoben unterteilt werden. Temperatur auch unterschiedlich beeinflussen die Struktur und die Eigenschaften der Proteinmoleküle. Zum Beispiel Protein Keratin – Haar- und Nagelkomponente niedriger und hoher Temperatur standhalten kann, das heißt ist thermolabil. Aber das Protein Ovalbumin, bereits erwähnt, wenn sie auf 80 bis 100 ° C erhitzt wird, vollständig zerstört. Dies bedeutet, dass sie in die Primärstruktur des Aminosäurerestes gespalten werden. Dieser Vorgang wird als Zerstörung genannt. Was auch immer die Bedingungen, wir haben nicht schaffen, in der nativen Form des Proteins zurückkehrt nicht. Motorproteins – Actin und milozin in den Muskelfasern. Ihre alternative Kontraktion und Entspannung ist die Grundlage der Muskelarbeit.