Kaliumchlorat
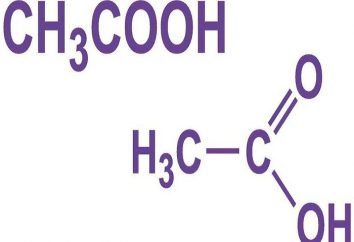
Sehr oft ist es eine Substanz namens Kaliumchlorat Salz, ein Chemiker mit dem Namen von Frankreich – Berthollet, der das Kaliumchlorat geöffnet, die Formel davon als KClO3 aufgezeichnet wird. Berthollets in ihren Experimenten Material durch Einwirkung von Chlor in alkalischer Lösung bei einer hohen Temperatur während der Reaktion erhalten. Als ein Ergebnis dieser Reaktion wurde Kaliumchlorid, Kaliumchlorat und drei Wassermoleküle. Wenn wir die Formel des Stoffes zu analysieren, sollten ihr Augenmerk auf das, was bertoletova Salz sehr reich an Sauerstoff bezahlen.
Äußerlich ist bertoletova Salz ein farbloser Kristalle, die eine Dichte von 2,32 Gramm pro Kubikzentimeter bei einer Temperatur 356oS zu schmelzen beginnen und bei 400 ° C aufweisen – zersetzen. Die Löslichkeit der Substanz beträgt 3,25 Gramm pro hundert Gramm einer wässrigen Lösung bei einer Temperatur von 0 ° C Mit zunehmender Temperatur wird die Löslichkeit von Kaliumchlorat steigt auch.
Bei ausreichender Heiztemperatur ist es sehr einfach zu Sauerstoffatomen „gescheitelt“, die durch eine solche Gleichung dargestellt werden kann: = 2KClO3 2KCl + 3O2.
-hydroxid oder -carbonat – typischerweise für Kaliumchlorat umgesetzt wird, in dem Chlorgas unter forcierten Luftdruck durch eine Hochtemperatur-Lösung von Kalium geleitet.
Während der Umsetzung mit Hydroxiden, wird Chlorstrom durch ein 30% iger Kaliumhydroxidlösung gerichtet ist, und wenn es als ein Filter wirkt Carbonate, konzentriert auf ein Niveau von 45% Kaliumcarbonat-Lösung verwendet.
Es ist wichtig, dass bei diesem Vorgang die resultierenden Kristalle Substanzen nicht verstopfen die gasführenden Pfade daher Nutzung während alonzha Reaktion bieten sollte.
Dann, Kaliumchlorat, in Form von Kristallen erhalten sollte gut durch Glaswolle filtriert und getrocknet werden. Es soll bei der Verwendung von Filtertechnologie Papiermaterialien vermieden werden, da bertoletova Salz mit der in dem Papier enthaltenen Faser reagieren kann, und eine Explosion verursachen.
Es gibt viele Möglichkeiten, durch die man Kaliumchlorat Salz bekommen. Wir beschreiben einige von ihnen.
Flag-Kolben Wurtz 5-10 Gramm Permanganat, und dann mit einem Trichter, der zuvor gewesen war notwendig, einen Kolben, der mit der Lösung, einen Stoß von etwa 30-70 Millimetern konzentrierter Salzsäure einzufügen. Besser macht im Allgemeinen Tropf, weil auf diese Weise geregelt effektiver durch die Geschwindigkeit der Bildung von Chlor während der Reaktion.
Holen Kaliumchlorat durch Elektrolyse und kann. Zu diesem Zweck eine konzentrierte Lösung von gewöhnlichem Salz zerlegt elektrischen Strom. Diese Reaktion wird wie folgt durchgeführt. Es dauert eine gewisse Menge an Salz, die beste nicht-jodiertes und grob. Die Qualität der Ausrüstung durch die beiden Elektroden aus Graphit, Glas, elektrische Leitungen, einen Becher, eine boden Kolben Wurtz verwendet. Drähte mit dem Abwärtstransformator über einen Gleichrichter, der wandelt Wechselstrom zu Gleichstrom. 80 Grad – Die Elektrolyse wurde bei einer Lösungstemperatur von 70 durchgeführt.
Die Reaktion bildet Kaliumchlorid, welches als bertoletova Salz viel mehr in Wasser löslich ist. Deshalb wird nach dem Verlauf der Reaktion, Kaliumchlorat an den Wänden des Gefßes abgelagert und das Kaliumchlorid wird in Wasser gelöst.
Bei der Durchführung verschiedene Experimente und Reaktionen mit der Substanz notwendig, die Aufmerksamkeit auf die Tatsache zu achten, dass Mischungen, insbesondere mit organischen Materialien – extrem explosiv, sowie „sensibel“ auf alle Arten von Schlägen zu reagieren, die Exposition gegenüber hohen Temperaturen. Zu den Wirkstoffen, die mit dem Chloratsalz reagieren umfassen Schwefel, Antimon, üblichen Ruß, roten Phosphor, auch Zucker und Stärke.
Eine besondere Gefahr ist Kaliumperchlorat – Kaliumperchlorat. Diese Verbindung hat eine sehr leistungsfähige explosiv, so als „Arbeitsmedium“ in Granaten, Geschosse und Minen verwendet wird. Bei Lagerzeiten verlängert, kann diese Verbindung spontan entzünden.