durch die Valenz der chemischen Elemente bestimmt
Die Kenntnis der Struktur von Atomen und Molekülen im XIX Jahrhundert kann nicht den Grund erklären, für das eine bestimmte Anzahl von Atomen Bindungen mit anderen Teilchen zu bilden. Aber die Ideen der Wissenschaftler ihrer Zeit voraus, und die Wertigkeit von noch als eines der Grundprinzipien der Chemie untersucht.
Aus der Geschichte des Begriffs der „Wertigkeit der chemischen Elemente“
Herausragende britische Chemiker XIX Jahrhundert Edvard Franklend prägte den Begriff „Kommunikation“ in der wissenschaftlichen Nutzung der Wechselwirkung der Atome miteinander zu beschreiben. Wissenschaftliche bemerkt, dass einige chemische Elemente Verbindungen mit der gleichen Menge anderer Atome bilden. Zum Beispiel legt Stickstoff drei Wasserstoffatome in einem Molekül von Ammoniak.
Im Mai 1852 legte Frank die Hypothese, dass es eine bestimmte Anzahl von chemischen Bindungen, die ein Atom mit anderen winzigen Teilchen der Materie bilden kann. Frank verwendet den Ausdruck „die Verbindungskraft“ zu beschreiben, was später Wertigkeit genannt werden würde. Britischer Chemiker gegründet als die chemischen Bindungen bilden Atom der einzelnen Elemente in der Mitte des XIX Jahrhunderts bekannt. Arbeit Frank war ein wichtiger Beitrag zur modernen Strukturchemie.

Entwicklung der Ansichten
Deutsch Chemiker FA Kekulé bewiesen 1857, dass Kohlenstoff chetyrehosnovnym ist. In seiner einfachsten Verbindung – methan – entstehen durch 4 Wasserstoffatome. Der Begriff „Basizität“ Wissenschaftler verwendete Elemente Eigenschaften eine feste Anzahl von anderen Teilchen verbinden zu bezeichnen. In Russland, Daten über die Struktur der Materie systematisiert A. M. Butlerov (1861). Die weitere Entwicklung der Theorie der chemischen Bindung in den Eigenschaften der Elemente, die die Lehren der periodischen Änderung erhalten durch. Sein Autor – ein weiterer herausragender russischer Chemiker D. I. Mendelejew. Es erwies sich, dass die Wertigkeit der chemischen Elemente in den Verbindungen und andere Eigenschaften durch die Position bestimmt werden, die sie im Periodensystem einnehmen.
 Graphische Darstellung der Valenz und die chemische Bindung
Graphische Darstellung der Valenz und die chemische Bindung
Die Möglichkeit der Darstellung Moleküle – eine der unbestrittenen Verdienste der Valenztheorie. Das erste Modell , erschien im Jahr 1860, und seit 1864 wurde unter Verwendung von Strukturformeln innerhalb repräsentierten chemische Umfangsmarkierung. Zwischen den Symbolen dash Atomen bezeichnet chemische Bindung ist , und die Anzahl der Zeilen ist, die der Wertigkeit gleich. In den gleichen Jahren wurde das erste sharosterzhnevye Modell (siehe. Bild links) aus. Im Jahr 1866 vorgeschlagen Kekules stereochemische Muster der Kohlenstoffatome in Form eines Tetraeders, die er in seinem Lehrbuch „Organic Chemistry“ enthalten.
Valence der chemischen Elemente, und die Entstehung von Beziehungen von G. Lewis studierten, der seine Werke nach der im Jahr 1923 veröffentlichten Entdeckung des Elektrons. Sogenannte negativ geladene winzige Partikel, die einen Teil der Atomhüllen sind. In seinem Buch verwendet Lewis einen Punkt um die vier Seiten des chemischen Symbols für die Anzeige der Valenzelektronen.
Valenz von Wasserstoff und Sauerstoff,
Vor der Erstellung des Periodensystems der Valenz der chemischen Elemente in den Verbindungen wurde hergestellt mit den Atomen , zu vergleichen mit dem es bekannt ist . Wasserstoff und Sauerstoff wurden als Referenz gewählt. Ein weiteres chemisches Element ist entweder angezogen für eine bestimmte Anzahl von H-Atomen substituiert ist, und O.
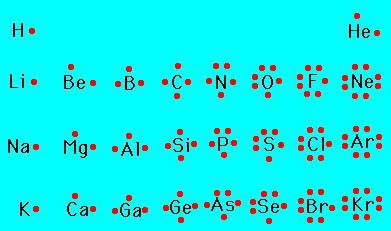
Auf dieser Weise wird die Eigenschaften wurden in einer einwertigen Verbindung mit Wasserstoff bestimmt (die Wertigkeit des zweiten Elements durch die römischen Ziffern bezeichnet):
- HCl – Chlor (I):
- H 2 O – Sauerstoff (II);
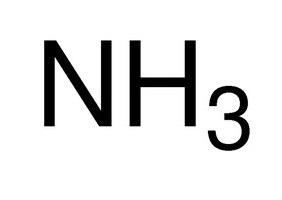
- NH 3 – Stickstoff (III);
- CH 4 – Kohlenstoff (IV).
Die Oxide von K 2 O, CO, N 2 O 3, SiO 2, SO 3 durch die Valenz der Metalle bestimmt wurden und Nichtmetallen Sauerstoff, die Anzahl der Atome anbringbar O. Verdopplungs Erhalten folgende Werte: K (I), C ( II), N (III) , Si (IV), S (VI).
Wie die Wertigkeit der chemischen Elemente zu bestimmen,
Es gibt Gesetze der Bildung von chemischen Bindungen mit den gemeinsamen Elektronenpaaren:
- Typische Wasserstoff Wertigkeit – I.
- Normale Sauerstoff Wertigkeit von – II.
- Bei Elementen Nichtmetalle niedrigere Wertigkeit durch die Formel 8 bestimmt werden können – № Gruppe, in der sie in dem Periodensystem ist. Höher, kann, wenn sie durch die Gruppennummer bestimmt werden.
- Für die Seitenelemente der Untergruppen maximal mögliche Wertigkeit ist die gleiche wie die Anzahl der Gruppen des Periodensystems.
Bestimmung der Valenz der chemischen Elemente der Verbindung der Formel durchgeführt wird unter Verwendung des folgenden Algorithmus:
- Nehmen Sie auf dem chemisch vertraut bekannten Wert für eines der Elemente. Zum Beispiel ist in Mn 2 O 7 Sauerstoff Wertigkeit II.
- Berechne den Gesamtwert, der durch die Valenz von der Anzahl der Atome des gleichen chemischen Elements im Molekül multipliziert werden muss, 2 * 7 = 14.
- Bestimmen Sie die Wertigkeit des zweiten Elements, für die es nicht bekannt ist. Dividieren erhalten in Sec. 2 Wert durch die Anzahl der Mn-Atome im Molekül enthalten.
- 14: 2 = 7. Die Valenz von Manganoxid in seinem höchsten – VII.
Permanente und variabler Valenz
Valence Werte von Wasserstoff und Sauerstoff sind unterschiedlich. Beispielsweise Schwefel in der Verbindung der H 2 S zweiwertig ist , wie in der Formel SO 3 – sechswertiges. Das Kohlenmonoxid reagiert mit Sauerstoff, CO und CO 2 dioxid. Die erste Verbindung ist die Wertigkeit von C II, und in den zweiten – IV. Der gleiche Wert in Methan CH 4.
Die meisten Elemente weisen keine konstante und variable Valenz, beispielsweise Phosphor, Stickstoff, Schwefel. Die Suche nach den Hauptursachen für dieses Phänomen führte zu einer Theorie der chemischen Bindung, Konzepte der Valenzschale Elektronen, Molekülorbitale. Die Existenz von verschiedenen Werten der gleichen Eigenschaften mit der Erläuterung der Struktur der Atome und Moleküle Position erhalten.
Moderne Konzepte der Wertigkeit
Alle Atome bestehen aus positiv geladenen Kern von negativ geladenen Elektronen umgeben. Die äußere Hülle, die sie bilden, ist nicht fertig. Die fertiggestellte Struktur ist die stabilste, enthält sie 8 Elektronen (Oktett). Die chemische Bindung mit den gemeinsamen Ergebnisse Elektronenpaare in energetisch günstigen Zustand Atome.
Regel für die Bildung von Verbindungen ist die Fertigstellung einer Schale oder Elektronen durch Empfangen ungepaarten recoil – je nachdem, ob der Prozess ist leichter zu passieren. Wenn Atom zur Bildung einer chemischen Bindung negativen Teilchen liefert keine Paar bildet die Bindungen es, solange es ungepaarte Elektronen. Nach modernen Konzepten, die Wertigkeit der Atome der chemischen Elemente – ist die Fähigkeit, eine bestimmte Anzahl von kovalenten Bindungen zu erzeugen. Zum Beispiel in dem Moleküle, H 2 S Schwefel, Schwefelwasserstoff erwirbt Valenz II (-), da jedes Atom in der Bildung von zwei Elektronenpaaren beteiligt ist . Das Zeichen „-“ zeigt die Attraktivität des Elektronenpaares an das elektro Element. Mindestens elektro auf den Wert der Wertigkeit anhängt „+“.
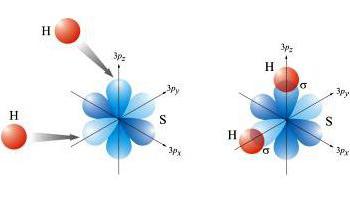
Als Donor-Akzeptor-Mechanismus ist in dem Prozess der Elektronenpaar von einem Elemente und den anderen freien Valenzorbitale beteiligt.
Die Abhängigkeit der Valenz von der Struktur des Atoms
Betrachten wir beispielsweise Kohlenstoff und Sauerstoff, wie sie auf die Struktur der Substanzen Valenz der chemischen Elemente abhängt. Periodic Table gibt einen Überblick über die grundlegenden Eigenschaften des Kohlenstoffatoms:
- chemisches Symbol – C;
- Artikelnummer – 6;
- Kernladung – 6;
- Protonen im Kern – 6;
- Elektronen – 6, einschließlich 4 externe, von denen 2 ein Paar bilden, 2 – ungepaarten.
Wenn das Kohlenstoffatom zwei Bindungen in monoookside CO bildet, dann ist seine Verwendung nur 6 negativ geladene Teilchen zugeführt wird. Zu erwerben octets benötigte 4 gebildet externe negative Teilchen zu koppeln. Kohlenstoff hat eine Wertigkeit von IV (+) in dioxid und IV (-) in Methan.
Ordinalzahl von Sauerstoff – 8, die Valenzschale besteht aus sechs Elektronen, von denen zwei ein Paar bilden und in chemischen Bindungen und Wechselwirkungen mit anderen Atomen beteiligt. Typische Sauerstoff Valenz – II (-).

Die Wertigkeit und Oxidationsstufe
In vielen Fällen ist es bequemer, den Begriff „Oxidationsgrad“ zu verwenden. So Ladungs Atom genannt, die sie erwerben würde, wenn alle Elektronen an das Bindungselement bewegt haben, die einen höheren Wert elektroootritsatelnosti hat (EO). Die Oxidationszahl der einfachen Substanz ist gleich Null. Durch Oxidation hinzugefügt mehr EO-Element "-" Zeichen, weniger elektro – "+". Zum Beispiel lädt die Hauptgruppenmetalle für typische Oxidation und Ionen gleiche Anzahl mit dem Vorzeichen der „+“. In den meisten Fällen die Wertigkeit und Oxidationsstufe von Atomen in der gleichen Verbindung numerisch übereinstimmen. Erst wenn die Interaktion mit mehr elektronegative Atome positiven Oxidationszustand, mit Elementen, deren EO unten – negativ. Das Konzept der „Wertigkeit von“ gilt oft nur auf die Substanz der molekularen Struktur.