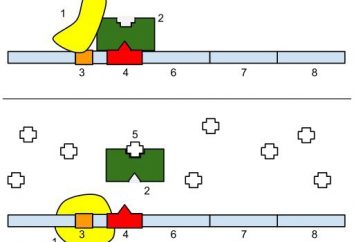
Das Enzym Katalase: Hauptmerkmale
Katalase – ein Enzym gefunden in fast allen lebenden Organismen. Seine Hauptfunktion – die Zersetzung von Wasserstoffperoxid in unschädliche Substanzen für den Organismus zu katalysieren. Katalase ist von großer Bedeutung für das Leben der Zellen, wie sie vor der Zerstörung durch reaktive Sauerstoffspezies schützt.
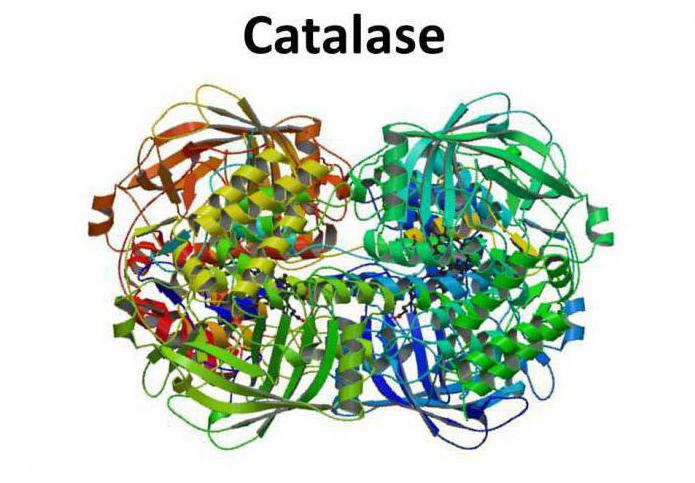
Überblick
Das Enzym Katalase betrifft Oxidoreduktase – breite Klasse von Enzymen, die den Transfer von Elektronen von der Reduktions Moleküle (Donor) zu dem Oxidationsmittel-Moleküle (Akzeptor) katalysieren.
Der optimale pH-Wert für Katalase im menschlichen Körper etwa 7 ist jedoch die Reaktionsgeschwindigkeit von 6,8 bis 7,5 in Werten des Wasserstoffindex nicht wesentlich ändert. Die pH-Optimum für andere Katalasen 4-11 reichen, abhängig von der Art des Organismus. Die optimale Temperatur ist auch unterschiedlich für eine Person ist , etwa 37 ° C
Katalase – eine der am schnellsten Enzyme. Nur ein Molekül in der Lage ist die Umwandlung seine Millionen von Molekülen von Wasserstoffperoxid zu Wasser und Sauerstoff pro Sekunde. In Bezug auf die Enzymologie, was bedeutet, dass eine große Anzahl von Umdrehungen Charakteristik des Enzyms Katalase.
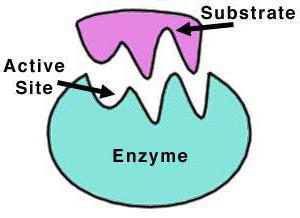
Struktur Enzym
Katalase ist ein Tetramer aus vier Polypeptidketten, von denen jeder mehr als 500 Aminosäuren in der Länge aufweist. Das Enzym wird von vier Gruppen von Häm Porphyr zusammengesetzt, und durch welcher reagiert mit aktiver Sauerstoffspezies. Die oxidierte Häm prosthetische Gruppe ist eine Katalase.
Geschichte der Entdeckung
Katalase wurde nicht an Wissenschaftler 1818 Jahre bekannt, bis Louis Jacques Thénard Chemiker in lebenden Zellen von Wasserstoffperoxid entdeckt wird, nicht, dass seine Zerstörung vorgeschlagen aufgrund der Wirkung eines unbekannten biologischen Materials.

Im Jahr 1900 führte ein deutscher Chemiker, Oskar Leo zuerst den „Katalase“ Begriff zu einem mysteriösen Substanz zu zersetzen Peroxid zu verweisen. Er war in der Lage, die Frage zu beantworten, wo das Enzym Katalase enthielt. Als Ergebnis zahlreicher Experimente zeigten, Oskar Leo, dass dieses Enzym von fast allen Tieren und Pflanzen charakteristisch ist. In lebenden Zellen sowie viele andere Enzyme Katalase in Peroxisomen enthalten.
Im Jahr 1937 war er die erste Katalase aus Rinderleber kristallisieren. 250 kD – Molekulargewicht des Enzyms wurde im Jahr 1938 bestimmt. 1981 Wissenschaftler haben Bilder von dreidimensionaler Struktur von Rinder-Katalase erhalten.
Die Katalyse von Wasserstoffperoxid
Trotz der Tatsache, dass Wasserstoffperoxid – ein Produkt von vielen normalen Stoffwechselprozessen, ist es für den Körper nicht harmlos.
 Um die Zerstörung von Zellen und Geweben zu verhindern, muß Wasserstoffperoxid schnell in anderen überführt werden, weniger gefährlich für den Körper. Es ist auf diese Herausforderung und meistert Enzym Katalase – es zersetzt sich das Peroxid zu zwei Moleküle von Wassermolekülen und Sauerstoffmoleküle.
Um die Zerstörung von Zellen und Geweben zu verhindern, muß Wasserstoffperoxid schnell in anderen überführt werden, weniger gefährlich für den Körper. Es ist auf diese Herausforderung und meistert Enzym Katalase – es zersetzt sich das Peroxid zu zwei Moleküle von Wassermolekülen und Sauerstoffmoleküle.
Die Reaktion von Wasserstoffperoxid Zersetzung in lebenden Geweben:
2 H 2 O 2 → 2 H 2 O + O 2
Der molekulare Mechanismus des Spaltungsenzyms von Wasserstoffperoxid durch Katalase ist noch nicht genau verstanden. Es wird angenommen, daß die Umsetzung in zwei Stufen stattfindet – die erste Stufe, bestehend aus Eisen Katalase prosthetische Gruppe an ein Sauerstoffatom des Peroxids gebunden ist, erzeugt dies ein Molekül Wasser. Im zweiten Schritt wird die Interaktion der oxidierte Häm mit einem anderen Moleküle von Wasserstoffperoxid, um dadurch ein anderes Molekül Wasser und ein Molekül Sauerstoff bildet.
Durch diese Wirkung des Enzyms Katalase für das Wasserstoffperoxid, wird die Anwesenheit des Wirkstoffs in den Gewebeproben leicht bestimmt. Um dies auf die Probe genug eine kleine Menge an Wasserstoffperoxid Probe und die Reaktion beobachten. Die Anwesenheit des Enzyms zeigt die Bildung von Sauerstoffblasen. Diese Reaktion ist gut, weil es keine speziellen Werkzeuge oder Geräte erforderlich ist – es kann mit dem bloßen Auge zu sehen.

Es ist erwähnenswert, dass ein Ion eines Schwermetalls als nicht-kompetitiver Inhibitor der Katalase wirken kann. Darüber hinaus verhält sich alle bekannten Cyanid als kompetitiver Inhibitor der Katalase, wenn in vielen Geweben von Wasserstoffperoxid. Arsenate wirkt als Aktivator.
Anwendung
Wirkung des Enzyms Katalase zersetzt sich Wasserstoffperoxid in der Lebensmittelindustrie verwendet – Verwendung dieses Enzyms wird aus der Milch entfernt H 2 O 2 auf die Herstellung von Käse. Eine weitere Anwendung – spezielle Lebensmittelverpackungen, die das Produkt vor Oxidation schützt. Katalase ist auch in der Textilindustrie zur Entfernung von Wasserstoffperoxid aus Geweben verwendet.
Es ist in der Hygiene von Kontaktlinsen in kleinen Mengen verwendet. Einige Desinfektionsmittel bestehen aus Wasserstoffperoxid und Katalase verwendet wird, um diese Komponente zu verteilen, bevor Linsen Wiederverwendung.
Aktivität
Die Aktivität der Katalase-Enzym hängt vom Alter des Organismus. Die jungen Gewebe der Enzymaktivität ist viel höher als in den alten. Mit zunehmendem Alter bei Menschen und bei Tieren allmählich abnimmt Katalase-Aktivität als Folge der Alterung von Geweben und Organen.
Laut einer aktuellen Studie, ist eine Abnahme der Katalase-Aktivität eine der möglichen Ursachen für Haar Vergrauung. Wasserstoffperoxid wird kontinuierlich in den menschlichen Körper produziert, aber kein Schaden – Katalase zersetzt es sich schnell. Aber wenn die Konzentration dieses Enzyms reduziert wird, ist es offensichtlich, dass nicht alle das Wasserstoffperoxid durch das Enzym katalysiert wird. So entfärbt es aus dem Innern des Haares durch natürlichen Farbstoffe zu lösen. Diese unerwartete Entdeckung derzeit von den Forschern getestet, und kann eine Rolle bei der Entwicklung von Medikamenten, die Aussetzung Ergrauen der Haare spielen.