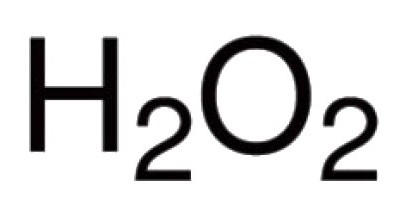Was ist die Wertigkeit von Sauerstoff in Verbindungen?
Um den möglichen Wert Valenz Sauerstoff zu bestimmen, sollte die Lage des Elements im Periodensystem, die Hauptmerkmale der Struktur seiner Atom untersuchen. Dieser Ansatz ist in der Untersuchung der Frage, was die Wertigkeit von Sauerstoff in typischen nützlich und was nicht für ihn typisch ist. Die am häufigsten verwendeten Verbindungen zeigen normale Wertigkeit – II. Mit dieser Funktion können Sie die Anzahl der Anleihen eines anderen Atoms in den fertigen binären Formeln denen Sauerstoff definieren.
Was ist die Wertigkeit von Sauerstoff in?
In der Anfangsphase der Akkumulation von Wissen über die Eigenschaften und Struktur von Substanzen Chemiker gedacht , dass die Wertigkeit – die Fähigkeit , eine bestimmte Anzahl von Atomen in einem Moleküle der Substanz zu binden. Viele Wissenschaftler nach der Entdeckung des Elements haben versucht zu verstehen, was die Wertigkeit von Sauerstoff in. Reaktion wurde durch Experiment erhalten: Sauerstoff misst zwei einwertiges Wasserstoffatom in einer chemischen Reaktion, das bedeutet divalente. Darstellungen von verschiedener chemischer Bindung mit der Anhäufung von Wissen über die Struktur der Substanzen. In seiner Theorie der Valenz von H. Lewis und W. Kossel die Art der chemischen Wechselwirkung mit der elektronischen Struktur Sicht offenbart. Die Forscher erklären, die Fähigkeit des Atoms eine bestimmte Anzahl von Verbindungen für den stabilsten Energiezustand Streben zu bilden. Im Fall von den kleinsten Teilchen Erreichen des Stoff stabiler wird. In der Theorie und Lewis Strukturen bezahlt viel Aufmerksamkeit auf die Rolle der äußeren Elektronen in der Schaffung einer chemischen Bindung beteiligt.
Eigenschaften von Sauerstoff Platzierung im Periodensystem
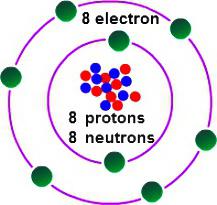
Um zu bestimmen , welche die Wertigkeit von Sauerstoff haben, ist es notwendig , einige Merkmale seiner zu berücksichtigen elektronischen Struktur. Sauerstoffkopfgruppe 16 des Periodensystems. Der gemeinsame Name der Familienmitglieder – „Chalkogene“ veralteter Klassifizierung sie VI (A) Gruppe gehören. Im Periodensystem von Sauerstoff in einer Zelle unter №8. Der Kern enthält in seiner Zusammensetzung 8 und die gleiche Anzahl von positiven neutralen Elementarteilchen. In dem Raum eines Atoms, gibt es zwei Energieniveaus , die auftreten , wenn Elektronen 8, 6 , von denen – den extern.

Welche Beziehung besteht zwischen der Zusammensetzung des Atoms und der Wertigkeit?
Auf der letzten Ebene des Sauerstoffatoms enthält zwei ungepaarte Elektronen. Das Element Fluor ist schlechter als der Wert der Elektronegativität (die Fähigkeit, Bindungselektronen Paar zu gewinnen). Bei der Bildung der Verbindungen mit anderen Elementen Sauerstoff zieht in dem Moleküle eine Gesamtelektronendichte (mit Ausnahme von Fluor Elektronen) entstanden. Erreichen eines stationären Zustands der Außenschale möglicherweise mit dem Zusatz von zwei negativen Ladungen. Dies bedeutet, dass Sauerstoff 2 Elektronen erforderlich ist. Mögliche folgende Optionen: accept ein Elektron (Wertigkeit II), weg von den anderen Atom 2 Elektronen (Wertigkeit II), nicht Elektronen von anderen Atomen (0 Wertigkeit) annehmen. Typisches Sauerstoffverhalten charakterisiert den zweiten Fall. Auf diese Weise können die Wertigkeit von Sauerstoff, um herauszufinden, was im typischen in ihrer gemeinsamen Verbindungen nutzen können. Dazu gehört eine Mehrheit von Oxiden von Metallen und Nichtmetallen.
Wie funktioniert eine Wertigkeit in Verbindungen?
Sauerstoff ist in der Lage mit Elementen viele der chemischen direkt zu interagieren. Bekannte seine Verbindungen mit praktisch alle Vertreter des Periodensystems (mit Ausnahme der inerten Gase Argon, Helium, Neon). Die Umsetzung mit Halogenen und Edelmetallen, Sauerstoff nicht direkt eingreifen kann, aber Oxide Au 2 O 3, F 2 O, Cl 2 O 7 und andere vorhanden ist (indirekt) erhalten. Für binäre Verbindungen bei der Bildung von Sauerstoff, der durch teilnimmt, gekennzeichnet eine kovalente Bindung und Polarität. Valenz in solchen Molekülen, hängt von der Anzahl von jeder Elektronenpaare, die an den Kern verschiedenen Atomen angezogen werden. In der überwiegenden Mehrheit der Verbindungen der Sauerstoffatome sind in der Schaffung von zwei kovalente Bindungen beteiligt. Zum Beispiel in den Oxiden von CO 2, P 2 O 5, SO 2, SO 3, K 2 O, B 2 O 3, Mo 2 O 5 und anderen Molekülen. Die Hydronium – Kation H 3 O + Sauerstoff zeigt atypische für ihn Wertigkeit III. Die Anwesenheit von Peroxo -OO- verursacht ungewöhnliche Natur von Wasserstoffperoxid H 2 O 2. Diese Verbindung zeigt eine charakteristische Sauerstoff es Valenz II.
Wie die Wertigkeit der bestimmen Elemente?
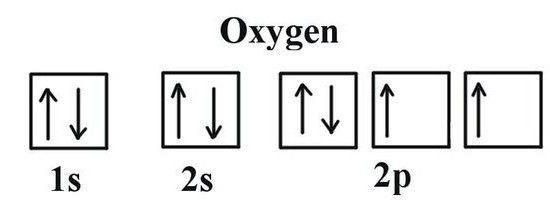
Der Begriff der Wertigkeit Sauerstoff gibt Möglichkeiten Lewis Struktur – chemisches Symbol Element, um die Elektronen Punkte, um die äußere Schicht zu markieren. Sie nehmen an der Schaffung von Molekülen, die einen Teil der geteilten Elektronenpaaren sind. Formel Lewis zeigt Sauerstoff Valenz der Anzahl seiner ungepaarten Elektronen (2) entspricht. Das gleiche Ergebnis wurde durch die Verwendung elektronischer Bildstrukturen erhalten. Die beiden Zellen der externen Sauerstoffpegel befindet ungepaarten Elektronen (durch Pfeile in der Formel angegeben ist). Weitere Informationen über das, was die Valenz von Sauerstoff in, in der letzten Formel für den Wert einer binären Verbindung benachbarter Atome ermöglicht. Um dies zu tun, führen einfache Berechnungen. Wird zunächst durch die Anzahl der O-Atome auf die Normalrate für die Sauerstoff Valenz multipliziert. Der sich ergebende Wert wird durch den Index geteilt werden, wie in der Formel mit dem chemischen Symbol nahe einem anderen Element festgelegt mit Sauerstoff in Kombination. Mit einem einfachen Verfahren berechnen wir die Kohlenstoff und Phosphor in Valenz deren Oxide.
- Multiplizieren des Index in der unteren rechten des Zeichens O dioxid in typischen CO 2 Valenz Element 2 • 2 = 4. Das sich ergebende Zahl Index für Kohlenstoff angegebenen einzuteilen: 4/1 = 4. Das Kohlendioxid CO 2 in seinem höchsten Wertigkeitszustand befindet IV .
- Index rechts unten auf dem chemischen Sauerstoff Symbol in Phosphoroxid P 2 O 5 multiplizieren die typische Valenz Atom O 5 • 2 = 10. Diese Zahl divide durch die Formel in dem Index auf der rechten unteren Ecke der Phosphoratome: 10/2 = 5. Das Phosphoroxid es ist an seiner höchsten Wertigkeit V.