Schwefelverbindungen. Grad der Schwefeloxidation in den Verbindungen. Schwefelverbindungen der Formel
Chalcogen-Untergruppe enthält Schwefel, – ein zweites Element, das der Bildung einer großen Anzahl von Erzablagerungen fähig ist. Sulfaten, Sulfiden, Oxiden andere Schwefelverbindungen sind sehr weit verbreitet und wichtige industrielle Natur. Daher wird sich in diesem Artikel werden wir auf das, was sie sind, bedeutet, dass ein Schwefel selbst, seine eine einfache Angelegenheit.

Schwefel und seine Charakterisierung
Dieses Element hat die folgende Stellung im Periodensystem.
- Die sechste Gruppe, die Hauptgruppe.
- Eine dritte kleine Periode.
- Atommasse – 32,064.
- Seriennummer – 16, Protonen und Elektronen sowie 16 Neutronen.
- Er bezieht sich auf die Elemente, Nichtmetalle.
- In den Formeln lesen, wie „es“, dem Namen des Elements Schwefel, Latin Schwefel.
In der Natur gibt es vier stabile Isotope mit Massenzahlen 32,33,34 und 36. Dieses Element der sechsten häufigsten in der Natur. Es bezieht sich auf die biogenen Elementen, als ein Teil der wichtigen organischen Molekülen.
Die elektronische Struktur des Atoms
Schwefelverbindungen sind aufgrund einer Vielzahl von Funktionen der elektronischen Struktur des Atoms. Es wird durch die folgende Formel ausgedrückt Konfiguration: 1s 2s 2 2 2 2p 6 3s 3p 4.
Die obige Reihenfolge reflektiert einen stationären Zustand des Elements. Aber wir wissen, dass, wenn das Atom zusätzliche Leistung zur Verfügung zu stellen, ist es möglich, Elektronen bei 3p und 3s-Unterschicht zu paaren brechen, gefolgt von einem weiteren Übergang zu 3D, das frei bleibt. Als Ergebnis ändert sich nicht nur die Wertigkeit des Atoms, sondern auch alle möglichen Oxidationsstufen. Ihre Zahl wird deutlich, wie auch die Anzahl verschiedener Substanzen mit Schwefel erhöht.
Grad der Schwefeloxidation in Verbindungen
Es gibt einige grundlegende Optionen dieses Indikators. Schwefel ist:
- -2;
- +2;
- 4;
- 6.
Von diesen sind die seltensten S 2, der Rest überall verstreut. Der Grad der Oxidation von Schwefelverbindungen in der abhängigen Reaktivität und Oxidationskraft aller Substanzen. Zum Beispiel können Verbindungen mit -2 – es Sulfiden. Sie betrachteten uns ein typisches Element des Oxidationsmittels.
Je höher der Grad der Oxidation in der Verbindung ist, desto ausgeprägter wird Oxidationsfähigkeit Substanz aufweist. Dies ist leicht zu sehen, wenn wir die beiden Gründe Säuren erinnern, die Schwefel bilden:
- H 2 SO 3 – schweflige;
- H 2 SO 4 – Schwefelsäure.
Es ist bekannt, dass letztere wesentlich stabiler ist, starke Verbindung, die eine hohe Konzentration von sehr ernster Fähigkeit, zu oxidieren.
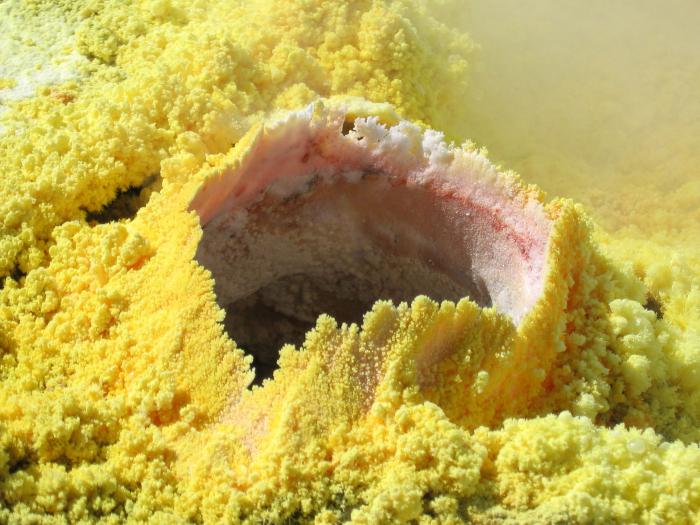
einfache Substanz
Als einfache Substanz Schwefel ist eine gelbe schöne Kristalle flach korrekt verlängert. Obwohl dies nur eine seiner Formen, weil es zwei Haupt sind allotropen Modifikationen dieser Substanz. Zuerst monokliner oder orthorhombischen – dies ist eine gelbe , kristalline Substanz, in Wasser nicht löslich, aber nur in organischen Lösungsmitteln. Gekennzeichnet Fragilität und schöne Form-Struktur in der Form einer Krone dargestellt. Schmelzpunkt – etwa 110 0 C.
Wenn Sie nicht über den Zwischenpunkt überspringen durch eine solche Modifikation erhitzt wird, ist es möglich, rechtzeitig einen anderen Zustand zu erkennen – Kunststoff Schwefel. Es ist ein kautschukartiges viskose braune Lösung, die bei weiterer Erhitzung oder wieder in die rhombische Form gelangt Abschrecken.
Wenn wir über chemisch reinen Schwefel, erhalten durch mehrere Filterungen sprechen, ist es eine leuchtend gelbe Kristalle klein, zerbrechlich und vollständig in Wasser unlöslich. Fähig Ignite bei Kontakt mit Feuchtigkeit und Luftsauerstoff. Differ ausreichend hohe chemische Aktivität.

in der Natur
In der Natur gibt es natürliche Ablagerung von denen Schwefelverbindungen sich als einfache Substanz extrahiert werden. Darüber hinaus enthält es:
- in Mineralien, Erze und Felsen;
- in Tieren, Pflanzen und Menschen, als ein Teil von vielen organischen Molekülen;
- in Erdgasen, Erdöl und Kohle;
- in Ölschiefer und natürlichen Gewässern.
Sie können ein paar der reichsten Schwefel Mineralien nennen:
- Zinnober;
- Pyrit;
- Sphalerit;
- stibnite;
- Galenit und andere.
Die meisten der Schwefel produziert heute geht an die Sulfatproduktion. Ein weiterer Teil wird für medizinische Zwecke, Landwirtschaft, Industriechemikalien Herstellungsverfahren verwendet.
physikalische Eigenschaften
Sie können in ein paar Absätze beschreiben.
- Das Wasser unlöslich ist in Kohlenstoffdisulfid, Terpentin, oder – gut gelöst.
- Längere Reibung ansammelt negative Ladung.
- Schmelzpunkt von 110 0 C.
- Der Siedepunkt von 190 0 C.
- Bei Erreichen von 300 0 C in gibt Flüssigkeit fließfähig.
- Eine reine Substanz ist in der Lage selbst entzünden brennbare Eigenschaften sehr gut sind.
- Für sich allein hat fast keinen Geruch, aber Wasserstoff Schwefelverbindungen emittieren einen scharfen Geruch nach faulen Eiern. Sowie einige Vertreter von gasförmigem binär.
Die physikalischen Eigenschaften des betreffenden Stoffes wurden seit der Antike zu den Menschen bekannt. Es ist für ihre Brennbarkeit von Schwefel und erhielt seinen Namen. In den Kriegen verwendet erstickende und giftige Dämpfe, die bei der Verbrennung der Verbindung, als Waffe gegen Feinde erzeugt werden. Darüber hinaus Schwefel mit Säure auch industrielle Bedeutung immer hatte.

chemische Eigenschaften
Betrifft: „Schwefel und seine Verbindungen“ finden nicht eine Lektion in der Schule Chemie Kurs, sondern mehrere. Immerhin eine Menge von ihnen. Dies ist aufgrund der chemischen Eigenschaften des Stoffes. Es kann mit einem starken Reduktionsmittel (Metalle, Bor, etc.), und der Wiederherstellung der meisten Nichtmetalle beiden Oxidations Eigenschaften sein.
Obwohl eine solche Aktivität nur mit Fluor Interaktion geht unter normalen Bedingungen. Für alle anderen, möchten Sie heizen. mehrere Kategorien von Materialien können bezeichnet werden, die zur Reaktion mit Schwefel geeignet ist:
- Metalle;
- Nichtmetalle;
- Alkalien;
- Stark oxidierende Säure – Schwefel- und Salpetersäure.
Schwefelverbindungen: Spezies
Variety ihr Wert wird durch unterschiedliche Oxidationsgrade Basiselements erläutert – Schwefel. Also, ein paar grundlegende Arten von Substanzen auf der Basis identifiziert werden:
- Verbindung mit der Oxidation -2;
- 4;
- 6.
Wenn man bedenkt, die Klassen und kein Indikator für die Wertigkeiten, dieses Element bildet solche Moleküle wie:
- Säure;
- Oxide;
- Wasserstoff Schwefelverbindungen;
- Salz;
- binäre Verbindungen mit Nichtmetallen (Kohlenstoffdisulfid, Chloriden);
- organische Substanzen.
Betrachten wir nun die wichtigsten sind, und Beispiele.

Substanzen mit Oxidations -2
Schwefelverbindungen 2 – ist seine Konformation mit Metallen, sowie:
- Kohlenstoff;
- Wasserstoff;
- Phosphor;
- Silizium;
- Arsen;
- Bor.
In diesen Fällen wirkt es als Oxidationsmittel, da all diese Elemente elektropositiveren. Betrachten Sie besonders wichtige.
- Schwefelkohlenstoff – CS 2. Die transparente Flüssigkeit mit einem angenehmen Aroma Äther. Ist giftig, brennbarer Stoff und explodiert. Verwendet als Lösungsmittel und für die meisten Arten von Ölen, Fetten, Nichtmetalle, Silbernitrat, Harze und Kautschuke. Es ist auch ein wichtiger Bestandteil bei der Herstellung von Kunstseide – Viskose. Die Industrie in großen Mengen synthetisiert.
- Schwefelwasserstoff oder Schwefelwasserstoff – H 2 S. Das Gas, da sie keine Farbe und süßen Geschmack. Geruch stark, sehr unangenehm, erinnert an faulen Eiern. Gift, drückt das Atemzentrum durch die Kupferionen verbinden. Deshalb, wenn es Erstickung und Tod kommt zu vergiften. in der Medizin, die organische Synthese, die Herstellung von Schwefelsäure und als energetisch günstige Rohstoffe weit verbreitet.
- Metallsulfide werden in der Medizin, in der Schwefelsäureproduktion, immer zur Herstellung von Farbleuchtstoffen und anderen Orten weit verbreitet. Allgemeine Formel – Me x S y.

Verbindungen, die einen Oxidationsgrad von +4 aufweist,
Schwefelverbindungen 4 – ist vorzugsweise ein Oxid, und die entsprechenden Salze und Säure. Alle von ihnen sind recht häufig Verbindungen, die einen bestimmten Wert in der Branche haben. Sie können als Oxidationsmittel wirken, aber die meisten zeigen reduzierende Eigenschaften.
Formel Schwefelverbindungen in der Oxidationsstufe +4 folgenden:
- oxide – Schwefeldioxid SO 2;
- acid – schweflige H 2 SO 3;
- Salze haben die allgemeine Formel Me x (SO 3) y.
Einer der häufigsten ist Schwefeldioxid, oder eines Anhydrids. Es ist eine farblose Substanz, die einen Geruch von verbranntem Einstimmungen hat. In großen Clustern während der Eruption von Vulkanen gebildet, der an dieser Stelle ist leicht mit dem Geruch zu identifizieren.
Es in Wasser gelöst unter Bildung von leicht zerfall acid – Schwefel. Es verhält sich wie ein typischer Säure Oxid bildet Salze, die ein Sulfition SO 3 2- enthalten. Dieses Anhydrid – Primärgas, das die Umgebungsatmosphäre Verschmutzung beeinträchtigt. Dass es wirkt sich auf die Bildung von Säure regen. Industriell in Schwefelsäureherstellung verwendet.
Verbindungen, in denen Schwefel in der Oxidationsstufe +6
Dazu gehören in erster Linie Schwefelsäureanhydrid und Schwefelsäure mit seiner Salze:
- Sulfate;
- Hydrogensulfat.
Da das Schwefel-Atom darin in dem höchsten Oxidationszustand ist, und die Eigenschaften dieser Verbindungen sind ganz erklärbar. Sie sind starke Oxidationsmittel.
Schwefeloxid (VI) – Schwefeltrioxid – stellt eine farblose flüchtige Flüssigkeit. Ein charakteristisches Merkmal – leistungsstarke Trocknungsfähigkeit. Im Freien raucht. Wenn in Wasser gelöst, stellt es eine der stärksten Mineralsäuren – Schwefelsäure. Die konzentrierte Lösung ist es schwer leicht gelbliche ölige Flüssigkeit. Wenn das Anhydrid in Schwefelsäure gelöst wird, erhält man eine bestimmte Verbindung genannt Oleum. Es wird in der Industrie für die Herstellung von Säure verwendet.
Unter Salzen – Sulfat – ist sehr wichtig, Verbindungen wie zum Beispiel:
- Gips CaSO 4 · 2H 2 O;
- Baryt BaSO 4;
- die Salze;
- Bleisulfat und andere.
Sie sind in Bau, die chemischen Synthese, die Medizin, die Herstellung von optischen Instrumenten und Gläsern und sogar die Lebensmittelindustrie verwendet.
Hydrogensulfate sind weit verbreitet in den Bereichen Metallurgie, wo als Flussmittel verwendet. Und sie helfen, viele der komplexen Oxide in lösliche Sulfatform zu übersetzen, die in den relevanten Industrien verwendet wird.
Die Studie von Schwefel in der Schule Chemiekurs
Wann ist die beste wird von Studenten der Assimilation von Wissen, das Schwefel ist, was seine Eigenschaften sind, die eine Verbindung von Schwefel? Grad 9 – die beste Zeit. Dies ist nicht der Anfang, wenn die Kinder alle neu und fremd. Dies ist die Mitte in der Studie der Chemie, als die zuvor gelegten Grundlagen, werden dazu beitragen, voll das Thema zu erfassen. Daher unter Berücksichtigung der Daten veröffentlichte sie in der zweiten Hälfte der Abschluss-Klasse ist. Das gesamte Thema ist in mehrere Blöcke unterteilt, die separat Lektion steht „Schwefelverbindungen. Klasse 9“.
Dies ist aufgrund ihrer großen Zahl. Auch separat für die Herstellung von Schwefelsäure in der Branche. Im Allgemeinen wird dieses Thema von durchschnittlich 3 Stunden.
Aber organische Verbindungen von Schwefel für Studie vorgelegt nur in der 10. Klasse, wenn Probleme organisch betrachtet. Auch sind und Biologie in der Schule betroffen. Tatsächlich Schwefel ist ein Teil von organischen Molekülen, wie zB:
- Thioalkohole (Thiole);
- Proteine (Tertiärstruktur, die die Bildung von Disulfidbrücken ist);
- Thioaldehyden;
- Thiophenole;
- Thioester;
- Sulfonsäure;
- Sulfoxide und andere.
Sie werden in einer separaten Gruppe von Organoschwefelverbindungen isoliert. Sie sind wichtig, nicht nur in den biologischen Prozessen der Lebewesen, sondern auch in der Industrie. Zum Beispiel, Sulfonsäure – die Basis vieler Medikamente (Aspirin, Sulfonamide oder streptocid).
Weiterhin Schwefelverbindungen, fester Bestandteil, wie einige:
- Aminosäuren;
- Enzyme;
- Vitamine;
- Hormone.