Eisen: die Struktur des Atoms, das System und den Beispielen. Die elektronische Struktur des Eisenatoms
Betrachten wir die elektronische Struktur des Eisenatoms sowie seine Position im Periodensystem. Identifizieren Sie die wichtigsten physikalischen und chemischen Eigenschaften des Elements, dem Einsatzgebiet.
Die Situation in der SS
Eisen ist ein Element, d-8-Gruppe (Übergangsgruppe). 26 hat eine Seriennummer, die relative Atommasse – 56, in seinem 26 – Atom enthält Protonen, Elektronen 26 und 30 Neutronen. Dieses Metall hat eine hohe Reaktivität, weist reduzierende Eigenschaften. Typische Oxidationsstufe +2, +3.
Merkmale der Struktur des Atoms
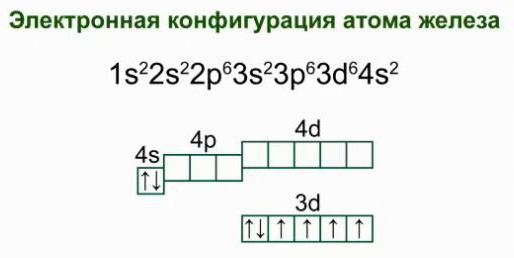
Was ist ein elektronisches Diagramm der Struktur eines Atoms von Eisen? Wenn wir die Verteilung der Elektronen in den Energieniveaus betrachten, erhalten wir die folgende Ausführung:
2e; 8e; 14e; 2e. Eine solche Struktur der Elektronenhülle eines Atoms von Eisen zeugt seiner Lage in den Untergruppen, bestätigt der Familie von Dr. Elemente gehören.

in der Natur
Eisen ist eines der häufigsten natürlich vorkommenden chemischen Elemente. In der Erdkruste beträgt dessen Anteil beträgt etwa 5,1%. In mehr in der Tiefen unseres Planeten gibt es nur drei Elemente: Silizium, Aluminium, Sauerstoff.
Eisenerze werden in verschiedenen Regionen der Erde gefunden. Alchemisten Verbindung dieses Metalls im Boden gefunden. Bei der Herstellung von Eisenerz wird in der ausgewählten das Gehalt 30 Prozent übersteigt.
Das magnetische Eisen enthält etwa zweiundsiebzig Prozent des Metalls. Grund Magnetitablagerungen sind in Kursk magnetischen Anomalien befindet, sowie im südlichen Ural. In Heliotrop Anteil an Eisen erreicht 65 Prozent. Hämatit wurde in Kriwoj Rog Bereich.

Der Wert für Pflanzen und Tiere
Welche Rolle in lebenden Organismen, führt Eisen? Die Struktur des Atoms erklärt seine regenerierenden Eigenschaften. Dieses chemische Element ist ein Teil von Hämoglobin, eine markante rote Farbe. Vor etwa drei Gramm reinem Eisen, von denen die meisten in Hämoglobin eingebaut ist, im Körper eines Erwachsenen gefunden. Der Hauptzweck ist, gebildet zu den Geweben der Lunge des aktiven Sauerstoff und den Entzug von Kohlendioxid zu übertragen.
Braucht dieses Metall und Pflanzen. Als Teil des Cytoplasmas, dauert es eine aktive Rolle in dem Prozeß der Photosynthese. Wenn die Anlage nicht genügend Eisen ist, haben die Blätter eine weiße Farbe. Mit minimalem dressing Salzen von Eisen Pflanzenblättern grün.
physikalische Eigenschaften
Wir haben die Struktur des Atoms von Eisen. Die Schaltung bestätigt, dass dieses metallischen Glanz Element (erhältlich Valenzelektronen). In einem silberweiße Metall relativ hohen Schmelzpunkt (1539 ° C). Durch die gute Duktilität des Metalls leicht Walzen sein, Stanzen, Schmieden.
Fähigkeit zur Magnetisierung und Entmagnetisierung charakteristisch für Eisen, machte es ein ausgezeichnetes Material für die Herstellung von Kernen leistungsstarke Elektromagneten in verschiedenen Fahrzeugen und Elektroautos.
Wie aktiv Eisen? Die Struktur zeigt die Anwesenheit des Atoms an der äußeren Ebene der beiden Elektronen, die im Verlauf einer chemischen Reaktion gegeben werden. Zur Erhöhung seiner Härte und Festigkeit, und führt zusätzliches Roll gehärtetes Metall. Solche Verfahren werden durch eine Änderung in der Struktur des Atoms nicht begleitet.

Eisenspezies
Die elektronische Struktur des Eisenatom, das System , das oben diskutiert wurde, erklärt ihre chemischen Eigenschaften. In handelsüblichen reinem Metall, das Stahl mit niedrigem Kohlenstoff, deren Hauptkomponente Eisen ist. Als Verunreinigung etwa 0,04 Prozent Kohlenstoff offenbart, enthält auch Phosphor, Stickstoff, Schwefel.
Chemisch reines Eisen auf seinen äußeren Parametern ähnlich wie Platin. Es hat eine hohe Beständigkeit gegenüber Korrosionsprozessen, stabil gegenüber Säuren. Bei der geringsten Verunreinigungen werden in einem reinen Metall seine einzigartigen Eigenschaften eingeführt verschwinden.
die Optionen für
Die Struktur aus Aluminium und Eisenatom amphoteren gehör zeigt die Hauptuntergruppe an Aluminium, die Möglichkeit, es in dem Prozess der Trennung von Eisen aus seinen Oxiden verwenden. Aluminothermie durchgeführt bei erhöhter Temperatur, kann es aus natürlichen Erzen reines Metall zuzuteilen. Zusätzlich zu Aluminium als ein starkes Reduktionsmittel ausgewählt ist Wasserstoff, ein Oxid von Kohlenstoff (2) und Kohle.
Besonders chemische Eigenschaften
Was sind die chemischen Eigenschaften von Eisen? Die Struktur des Atoms erklärt seine reduzierende Wirkung. Für Eisen, die durch die Bildung von zwei Reihen von Verbindungen mit der Oxidationsstufe +2, +3 gekennzeichnet.
In feuchter Luft, gibt es ein Verfahren Rost (Korrosion) des Metalls, was zur Bildung von Eisenhydroxid (3). Mit Sauerstoff erhitzt Eisendraht mit dem Aufkommen des schwarzen Eisenoxidpulver (2,3) reagiert, genannt ein Eisenoxid-Skala.
Bei hohem Temperatur Metall fähig ist, mit Wasserdampf reagieren kann, wodurch ein Mischoxid bilden. Der Prozess wird durch Wasserstoffentwicklung begleitet.
Reaktion mit Nichtmetallen erfolgt nur an der Vorwärmung der Ausgangskomponenten.
Eisen kann ohne Vorheizen des Gemisches in verdünnter Schwefelsäure oder Salzsäure, gelöst werden. Konzentrierte Schwefelsäure und Salzsäure passivieren das Metall.
Was sonst hat chemische Eigenschaften Eisen? Die Struktur eines Atoms des Elements angibt, seine durchschnittliche Aktivität. Dieser Ort wird Eisen zu Wasserstoff (H2) in der elektrochemischen Reihe bestätigt. Folglich kann es aus den Salzen aller Metalle verdrängen, die nach rechts in der Zeile Beketova befinden. Somit Reaktion mit Kupfer (2) wird unter Erhitzen durchgeführt wird, ist eine Zuweisung von reinem Kupfer und Erhalten Eisenchloridlösung (2).
 Anwendungen
Anwendungen
Der überwiegende Teil des Gesamteisens wird in der Herstellung von Eisen und Stahl verwendet. Der Eisengehalt Kohlenstoffgehalt von 3-4 Prozent im Stahl – nicht mehr als 1,4 Prozent. Das nicht-metallische Element führt die Funktion der Bindungsstärke zu erhöhen. Darüber hinaus wirkt sich dies positiv auf die Korrosionseigenschaften der Legierungen erhöht die Widerstandsfähigkeit des Materials auf eine erhöhte Temperatur.
Vanadium Additive erforderlich, die mechanische Festigkeit des Stahls zu verbessern. Chrom erhöht die Beständigkeit gegenüber aggressiven Chemikalien.
Ferromagnetische Eigenschaften dieses chemischen Elements machten es in industriellen Anwendungen beliebt, auch in den Elektromagneten. Darüber hinaus fand das Eisen seine Verwendung in der Souvenirindustrie. Eine Basis für verschiedene Andenken solche bunten Magneten auf Kühlschranks zu erzeugen.
Festigkeit und Duktilität ermöglichen die Verwendung von Metall für die Schaffung von Rüstung, mit verschiedenen Waffen.
Eisen-III-Chlorid (3) zur Reinigung von Wasser von Verunreinigungen verwendet. In der Medizin 26 Element Periodensystem in der Behandlung von Krankheiten wie Anämie verwendet. Im Fall eines Mangels an roten Blutkörperchen gibt es Müdigkeit, Haut unnatürlich blassen Teint. Eisenpräparate helfen, diese Art von Problem zu beseitigen, bringen Sie den Körper zu normalen Aktivitäten. Eisen hat besondere Bedeutung für die Aktivität der Schilddrüse, die Leber. So in dem menschlichen Körper ist keine ernsthaften Probleme, verbrauchen genug täglich etwa 20 mg des Metalls.














