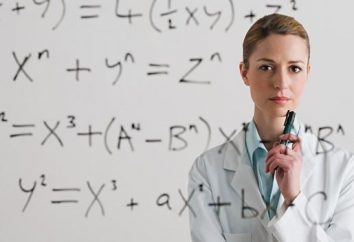Raoult Gesetz.
Raoult Gesetz wurde im Jahr 1887 eine der berühmtesten Französisch Physiker, etabliert. Sein Name er trägt. Raoult Gesetz basiert auf bestimmte Verbindungen, die den Dampfdruck der Verdünnung von Nicht-Elektrolyten zu reduzieren. Vergleichsdruckreduzierung Paar identisch mit der Molenbruch der verdünnten Substanz imprägniert. Dieses Gesetz brachte Französisch Wissenschaftler studieren vielfältige Lösungen Flüssigkeiten (nicht flüchtig) und Substanzen (Feststoffe).
Von Raoult Gesetz kann in einem Verhältnis des Gefrierpunktes der verdünnten Lösung eine Erhöhung der Siedetemperatur oder zu verringern mit dem Molanteil unverdünnten Akkumulation und verwendet , um seine finden gelernt, dass Molekulargewicht.
Die ideale Lösung heißt so, dass alle seine Eigenschaften die entsprechenden Anforderungen des Gesetzes von Raul passen. Weitere Näherungslösungen können nur diejenigen, die auf die nicht-polaren Gasen und Flüssigkeiten gehören in Betracht gezogen werden. Das heißt, sie die Moleküle bilden müssen nicht seine Richtung in dem vorhandenen elektrischen Feld ändern. Folglich wird die Wärme der Offenbarung Null sein. Dann wird die Eigenschaften der Lösungen werden leicht zu finden, da es notwendig ist, nur ihre ursprüngliche Eigenschaft Komponente und die Verhältnismäßigkeit zu berücksichtigen, in denen das Mischen haticheskim Art und Weise erfolgt.
Mit diesen Lösungen eine solche Berechnung machen, ist fast unmöglich. Da die Bildung von Lösungen, erzeugt in der Regel Wärme oder die umgekehrte Situation auftritt – diese Lösung absorbiert Wärme in sich.
Es forderte den exothermen Prozess, bei dem der Wärmeerzeugung auftritt, und den endothermen Prozess – ein, wo es absorbiert wird.
Kolligativen Eigenschaften der Lösung sind diejenigen , die in erster Linie abhängig von der sind die Konzentration der Lösung, und nicht von der natürlichen verdünnter natürliche Substanz. Kolligative großen Abmessungen sind Druck, Temperatur und das Einfrieren der Lösung selbst den proportionalen Druck der Lösungsmitteldämpfe.
Das erste Gesetz von Raul verbindet den konzentrierten Druck von Dampf über eine Lösung seine Zusammensetzung. Die Definition dieses Gesetzes wird wie folgt geschrieben: Pi Pio * Xi =.
Der proportionale Druckdampf in Lösungen der Komponenten angesammelt ist, um seinen Wert Molenbrüche in der Lösung direkt proportional. Der Proportionalitätskoeffizient gleich den Dampfdruck über der konzentrierte unlösliche Komponente.
Da die gesamte kombinierte Ergebnis der Molfraktionen gesamten Komponenten der Lösungen 1 ist, dann für die binäre Lösung, bestehend aus Komponenten, wie A und B, können wir ableiten, resultierende Verhältnis fällt auch mit der Expression des ersten Raoult'schen Gesetz: (P0A-PA) / P0A = XB.
Das zweite Gesetz von Raul – dies ist eine Folge des ersten Gesetzes, nach dem Wissenschaftler aus Frankreich benannt. Dieses Gesetz gilt nur für einige verdünnten Lösungen.
Die Verringerung des Gefrierpunktes sorgfältig verdünnte Lösungen von nichtflüchtigem Material in direktem Verhältnis zu der Anhäufung von molaler Lösungen, und sie haben keine Abhängigkeit von natürlichen Substanzen verdünnt: T0fr-TFR = TFR = Km.
Eine Erhöhung des Siedepunktes einige verdünnte Lösungen von nichtflüchtigen Substanzen sind nicht von der Art des verdünnten Substanz abhängig, und es ist direkt proportional Komponente molal Lösungen: T0b-TB = TB = Em .
Ebullioskopicheskaya konstant, d.h. kkoeffitsient E – ist der Unterschied zwischen der direkten Lösung Siedetemperatur und vollständig unverdünnter Lösung.
Kryoskopischer konstant, das heißt der Koeffizient K – ist der Unterschied zwischen der Lösung und Gefriertemperatur vollständig unverdünnten Lösung.