Ammoniak ist ein Antipode und analog … von Wasser?
Der Geruch dieses Gases ist jedem bekannt – man kann es sofort fühlen, wenn man das Glas mit Ammoniak öffnet. Etwas über seine Eigenschaften wurde uns in der Schule erzählt. Es ist auch bekannt, dass es eines der Schlüsselprodukte der chemischen Industrie ist: Es ist in ihm, dass es einfacher ist, Stickstoff zu drehen, was nicht gern in chemische Reaktionen eintritt. Ammoniak ist der erste Punkt, aus dem die Produktion vieler stickstoffhaltiger Verbindungen beginnt: verschiedene Nitrite und Nitrate, Sprengstoffe und Anilinfarbstoffe, Arzneimittel und Polymermaterialien …
Kurzinformation
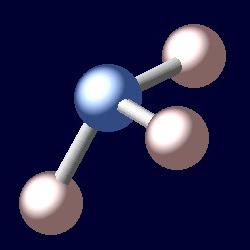 Der Name dieser Substanz stammt aus den griechischen "Hals Ammoniakos", die in der Übersetzung Ammoniak bedeutet. Das Molekül Ammoniak ist eine Art Pyramide, an deren Spitze sich ein Stickstoffatom befindet, und an der Basis – drei Wasserstoffatome. Die Formel für diese Verbindung ist NH3. Unter normalen Bedingungen ist Ammoniak ein farbloses Gas mit einem asphyxiierenden, scharfen Geruch. Seine Dichte bei -33,35 ° C (der Siedepunkt) beträgt 0,681 g / cm 3 . Und diese Substanz schmilzt bei -77.7 ° С. Die Molmasse Ammoniak beträgt 17 Gramm pro Mol. Der Druck von 0,9 MPa bewirkt, dass sich das Ammoniak bei Raumtemperatur zusammenzieht. Es wird in der Industrie unter Druck durch katalytische Synthese aus Wasserstoff und Sauerstoff produziert. Flüssiges Ammoniak ist ein hochkonzentrierter Dünger, ein Kältemittel. Bei dieser Substanz ist darauf zu achten, dass es giftig und explosiv ist.
Der Name dieser Substanz stammt aus den griechischen "Hals Ammoniakos", die in der Übersetzung Ammoniak bedeutet. Das Molekül Ammoniak ist eine Art Pyramide, an deren Spitze sich ein Stickstoffatom befindet, und an der Basis – drei Wasserstoffatome. Die Formel für diese Verbindung ist NH3. Unter normalen Bedingungen ist Ammoniak ein farbloses Gas mit einem asphyxiierenden, scharfen Geruch. Seine Dichte bei -33,35 ° C (der Siedepunkt) beträgt 0,681 g / cm 3 . Und diese Substanz schmilzt bei -77.7 ° С. Die Molmasse Ammoniak beträgt 17 Gramm pro Mol. Der Druck von 0,9 MPa bewirkt, dass sich das Ammoniak bei Raumtemperatur zusammenzieht. Es wird in der Industrie unter Druck durch katalytische Synthese aus Wasserstoff und Sauerstoff produziert. Flüssiges Ammoniak ist ein hochkonzentrierter Dünger, ein Kältemittel. Bei dieser Substanz ist darauf zu achten, dass es giftig und explosiv ist.
Neugierige Fakten
Flüssiges Ammoniak hat eher ungewöhnliche Eigenschaften. Nach außen ähnelt es einfachem Wasser. Wie H 2 O löst es viele organische und anorganische Verbindungen perfekt auf . Die meisten Salze in ihm dissoziieren, wenn in Ionen aufgelöst. Gleichzeitig treten chemische Reaktionen im Gegensatz zu Wasser ganz anders auf.
|
ZnCl & sub2; |
BaCl 2 |
KCl |
NaCl |
KI |
Ba (NO & sub3;) & sub2; |
AgI |
||
|
Löslichkeit bei 20 ° C, bezogen auf 100 g Lösungsmittel |
Ammoniak |
0 |
0 |
0,04 |
3 |
182 |
97 |
207 |
|
Wasser |
367 |
36 |
34 |
36 |
144 |
9 |
0 |
|
Die Daten in dieser Tabelle führen zu der Vorstellung, dass flüssiges Ammoniak ein einzigartiges Medium für die Durchführung bestimmter Austauschreaktionen ist, die in wässrigen Lösungen praktisch nicht durchführbar sind.  Zum Beispiel:
Zum Beispiel:
2AgCl + Ba (NO & sub3;) & sub2; = 2AgNO & sub3; + BaCl & sub2 ;.
Da NH 3 ein starker Protonenakzeptor ist, wird Essigsäure trotz der Tatsache, dass es als schwach angesehen wird, vollständig dissoziieren, genauso wie starke Säuren. Von größtem Interesse sind Lösungen in Ammoniakalkohol von Alkalimetallen. Schon 1864 bemerkten die Chemiker, daß, wenn ihnen etwas Zeit gegeben würde, Ammoniak verdampfen würde, und im Sediment wäre reines Metall. Fast das gleiche passiert mit wässrigen Salzenlösungen. Der Unterschied besteht darin, daß die Alkalimetalle, wenn auch in geringer Menge, aber noch mit Ammoniak reagieren, was zur Bildung von Salzamiden führt:
2Na + 2NH3 = 2NaNH2 + H2.
Letztere sind ziemlich stabile Stoffe, aber wenn sie mit Wasser in Berührung kommen, zerfallen sie sofort:
NaNH & sub2; + H & sub2; & sub0; = NH & sub3; + NaOH
 Bei der Untersuchung der Eigenschaften von flüssigem Ammoniak haben die Chemiker darauf aufmerksam gemacht, daß, wenn sich das Metall darin löst, das Volumen der Lösung größer wird. Darüber hinaus nimmt seine Dichte mit diesem ab. Dies ist ein weiterer Unterschied zwischen dem fraglichen Lösungsmittel und dem gewöhnlichen Wasser. Es ist schwer zu glauben, aber die konzentrierte und verdünnte Lösung eines Alkalimetalls in flüssigem Ammoniak vermischt sich nicht, trotz der Tatsache, dass das Metall in beiden gleich ist! Dank der Experimente werden ständig neue und überraschende Fakten entdeckt. So stellte sich heraus, dass die in flüssigem Ammoniak eingefrorene Natriumlösung sehr wenig Widerstand hat und daher NH 3 zur Herstellung eines supraleitenden Systems verwendet werden kann. Es ist nicht verwunderlich, dass dieses Gas und seine Lösungen für die Köpfe von Physikern und Chemikern immer noch interessant sind.
Bei der Untersuchung der Eigenschaften von flüssigem Ammoniak haben die Chemiker darauf aufmerksam gemacht, daß, wenn sich das Metall darin löst, das Volumen der Lösung größer wird. Darüber hinaus nimmt seine Dichte mit diesem ab. Dies ist ein weiterer Unterschied zwischen dem fraglichen Lösungsmittel und dem gewöhnlichen Wasser. Es ist schwer zu glauben, aber die konzentrierte und verdünnte Lösung eines Alkalimetalls in flüssigem Ammoniak vermischt sich nicht, trotz der Tatsache, dass das Metall in beiden gleich ist! Dank der Experimente werden ständig neue und überraschende Fakten entdeckt. So stellte sich heraus, dass die in flüssigem Ammoniak eingefrorene Natriumlösung sehr wenig Widerstand hat und daher NH 3 zur Herstellung eines supraleitenden Systems verwendet werden kann. Es ist nicht verwunderlich, dass dieses Gas und seine Lösungen für die Köpfe von Physikern und Chemikern immer noch interessant sind.