Der Grad der Oxidation ist welcher Wert? Wie kann man den Oxidationsgrad der Elemente bestimmen?
Ein solches Thema des Schulcurriculums als Chemie verursacht für die meisten modernen Schüler zahlreiche Schwierigkeiten, wenige können den Grad der Oxidation in Verbindungen bestimmen. Die größten Schwierigkeiten für Schulkinder, die anorganische Chemie studieren, das heißt, Studenten der Hauptschule (Noten 8-9). Das Missverständnis des Subjekts führt zu dem Auftreten von Abneigung bei den Schülern in diesem Thema.
Lehrer identifizieren eine Reihe von Gründen für solche "Abneigung" der mittleren und älteren Studenten in der Chemie: Zurückhaltung, komplexe chemische Begriffe zu verstehen, Unfähigkeit, Algorithmen zu verwenden, um einen bestimmten Prozess zu betrachten, Probleme mit mathematischen Kenntnissen. Das Ministerium für Bildung der Russischen Föderation führte eine wesentliche Veränderung des Inhalts des Themas ein. Darüber hinaus "schneiden" und die Anzahl der Stunden für den Unterricht Chemie. Dies beeinträchtigte die Qualität des Wissens zu diesem Thema, die Abnahme des Interesses an dem Studium der Disziplin.

Welche Themen des Chemiekurses sind für Schulkinder am schwierigsten?
Unter dem neuen Programm im Rahmen der Disziplin "Chemie" der Hauptschule gibt es einige ernsthafte Themen: Periodensystem von D. Mendeleyevs Elementen, Klassen von anorganischen Substanzen, Ionenaustausch. Es ist am schwierigsten für Achtel-Grader, die Oxidationsstufe von Oxiden zu bestimmen.
Regeln der Vereinbarung
Zuerst sollten sich die Schüler bewusst sein, dass Oxide komplexe Zweielementverbindungen sind, in denen Sauerstoff enthalten ist. Eine obligatorische Bedingung für die binäre Verbindung, die zur Klasse der Oxide gehört, ist die Position des Sauerstoffs in der zweiten Verbindung in dieser Verbindung.
Um einen solchen Indikator in irgendwelchen Formeln dieser Klasse zu berechnen, wird nur dann erhalten, wenn der Schüler einen bestimmten Algorithmus hat.
Algorithmus für Säureoxide
Zunächst stellen wir fest, dass der Grad der Oxidation ein numerischer Ausdruck für die Wertigkeit der Elemente ist. Säureoxide werden durch Nichtmetalle oder Metalle mit einer Wertigkeit von vier bis sieben gebildet, die zweite in solchen Oxiden notwendigerweise Sauerstoff.
In Oxiden entspricht die Sauerstoffvalenz immer zwei, sie kann aus dem Periodensystem der Elemente von DI Mendeleyev bestimmt werden. Ein solches typisches Nichtmetall wie Sauerstoff, das in der 6. Gruppe der Hauptuntergruppe des Periodensystems liegt, nimmt zwei Elektronen, um sein externes Energieniveau vollständig zu vervollständigen. Nichtmetalle in Verbindungen mit Sauerstoff zeigen meist eine höhere Wertigkeit, die der Zahl der Gruppe selbst entspricht. Es ist wichtig, daran zu erinnern, dass der Grad der Oxidation von chemischen Elementen ein Indikator ist, der eine positive (negative) Zahl annimmt.
Das Nicht-Metall, das am Anfang der Formel steht, hat eine positive Oxidationsstufe. Nichtmetall-Sauerstoff in Oxiden ist stabil, sein Index ist -2. Um die Zuverlässigkeit der Anordnung von Werten in sauren Oxiden zu verifizieren, müssen Sie alle Zahlen multiplizieren, die Sie auf die Indizes eines bestimmten Elements setzen. Berechnungen gelten als zuverlässig, wenn die Summe aller Vor- und Nachteile der ausgegebenen Abschlüsse 0 beträgt.

Zusammenstellung von Zwei-Element-Formeln
Der Grad der Oxidation von Atomen von Elementen gibt eine Chance, Verbindungen aus zwei Elementen zu erzeugen und aufzuzeichnen. Bei der Erstellung einer Formel sind zunächst beide Symbole nebeneinander vorgeschrieben, der Sauerstoff ist der zweite. Über jedem der aufgezeichneten Zeichen sind die Werte der Oxidationsgrade vorgeschrieben, dann ist zwischen den gefundenen Zahlen die Zahl, die in beide Ziffern ohne irgendeinen Rest aufgeteilt wird. Dieser Indikator muss getrennt durch den numerischen Wert des Oxidationsgrades geteilt werden, wobei Indizes für die erste und die zweite Komponente der Zweielement-Substanz erhalten werden. Der höchste Grad der Oxidation ist gleichbedeutend mit dem Wert der höchsten Wertigkeit eines typischen Nichtmetalls, identisch mit der Zahl der Gruppe, in der das Nichtmetall in der PS ist.
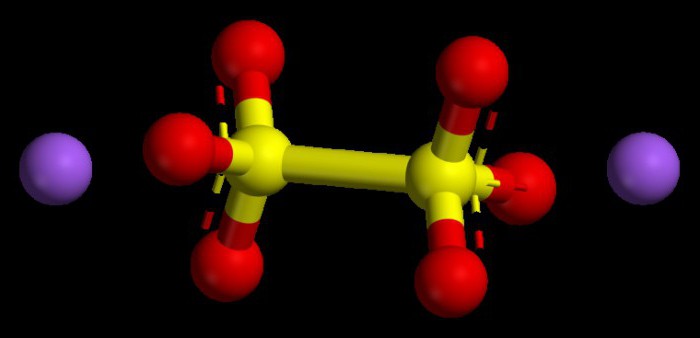
Algorithmus zur Einstellung von Zahlenwerten in Grundoxiden
Ähnliche Verbindungen sind Oxide von typischen Metallen. Sie haben in allen Verbindungen einen Oxidationsindex von nicht mehr als +1 oder +2. Um zu verstehen, was der Grad der Oxidation des Metalls sein wird, können wir das periodische System verwenden. Bei Metallen der Hauptuntergruppen der ersten Gruppe ist dieser Parameter immer konstant, er ähnelt der Gruppennummer, also +1.
Metalle der Hauptuntergruppe der zweiten Gruppe zeichnen sich auch durch einen stabilen Oxidationsgrad, in numerischer Hinsicht +2 aus. Die Oxidationsgrade der Oxide in der Summe unter Berücksichtigung ihrer Indizes (Zahlen) sollten null geben, da ein chemisches Molekül als neutral, ohne Ladung, als Teilchen betrachtet wird.
Die Anordnung der Oxidationsgrade in sauerstoffhaltigen Säuren
Säuren sind komplexe Substanzen, die aus einem oder mehreren Wasserstoffatomen bestehen, die mit einigen sauren Resten assoziiert sind. Angesichts der Tatsache, dass Oxidationsstufen digitale Indikatoren sind, werden einige mathematische Fähigkeiten benötigt, um sie zu berechnen. Ein solcher Indikator für Wasserstoff (Proton) in Säuren ist immer stabil, ist +1. Dann können Sie den Grad der Oxidation für ein negatives Sauerstoff-Ion angeben, es ist auch stabil, -2.
Erst nach diesen Aktionen ist es möglich, die Oxidationsstufe der zentralen Komponente der Formel zu berechnen. Als spezifische Probe betrachten wir die Bestimmung des Oxidationsgrades von Elementen in Schwefelsäure H2SO4. Wenn man bedenkt, daß im Molekül einer gegebenen komplexen Substanz zwei Wasserstoffprotonen, vier Sauerstoffatome, enthalten, so erhält man einen Ausdruck von diesem Typ + 2 + X-8 = 0. Damit die Summe Null bildet, hat Schwefel einen Oxidationszustand von +6
Die Anordnung der Oxidationsgrade in Salzen
Salze sind komplexe Verbindungen, die aus Metallionen und einem oder mehreren Säureresten bestehen. Das Verfahren zur Bestimmung der Oxidationsgrade in jedem der Bestandteile in einem komplexen Salz ist das gleiche wie bei sauerstoffhaltigen Säuren. Da der Grad der Oxidation von Elementen ein digitaler Indikator ist, ist es wichtig, den Oxidationsgrad des Metalls korrekt zu identifizieren.
Wenn das Metall, das das Salz bildet, sich in der Hauptuntergruppe befindet, ist sein Oxidationsgrad stabil, entsprechend der Gruppennummer, ein positiver Wert. Wenn das Salz ein Metall einer ähnlichen Untergruppe des PS enthält, das verschiedene Valenzen aufweist, kann die Valenz des Metalls aus dem Säurerest bestimmt werden. Sobald der Oxidationszustand des Metalls festgestellt ist, setzen Sie den Oxidationszustand von Sauerstoff (-2), dann berechnen Sie den Grad der Oxidation des zentralen Elements mit der chemischen Gleichung.
Als Beispiel betrachten wir die Bestimmung der Oxidationsgrade in Elementen in Natriumnitrat (mittleres Salz). NaNO3 Das Salz wird durch das Metall der Hauptgruppe der Gruppe 1 gebildet, daher wird der Oxidationsgrad von Natrium +1 sein. Sauerstoff in Nitraten hat einen Oxidationsgrad von -2. Um den numerischen Wert des Oxidationsgrades zu bestimmen, gilt die Gleichung + 1 + X-6 = 0. Wenn wir diese Gleichung lösen, erhalten wir, dass X +5 sein sollte. Dies ist der Grad der Stickoxidoxidation.

Grundbegriffe in OVR
Für die Oxidation, sowie die Erholung Prozess gibt es spezielle Begriffe, die Schulkinder erforderlich sind, um zu lernen.
Der Grad der Oxidation eines Atoms ist seine direkte Fähigkeit, Elektronen von einigen Ionen oder Atomen zu befestigen (anderen zu geben).
Oxidationsmittel gilt als neutrale Atome oder geladene Ionen, im Zuge einer chemischen Reaktion legen sie Elektronen an sich.
Der Wiederhersteller sind ungeladene Atome oder geladene Ionen, die ihre eigenen Elektronen im Prozess der chemischen Wechselwirkung verlieren.
Oxidation wird als Verfahren zur Freisetzung von Elektronen dargestellt.
Die Wiederherstellung ist mit der Annahme von zusätzlichen Elektronen durch ein ungeladenes Atom oder Ion verbunden.
Das Oxidations-Reduktionsverfahren ist durch eine Reaktion gekennzeichnet, bei der sich der Oxidationsgrad des Atoms notwendigerweise ändert. Diese Definition erlaubt uns zu verstehen, wie es möglich ist zu bestimmen, ob die OVR-Reaktion ist.

Regeln für das Analysieren von IAD
Mit diesem Algorithmus können Sie die Koeffizienten in jeder chemischen Reaktion anordnen.
-
Zuerst müssen Sie die Oxidationsstufen in jede chemische Substanz stellen. Beachten Sie, dass in einer einfachen Substanz der Grad der Oxidation Null ist, da es keine Rückstoß (Anhaftung) von negativen Partikeln gibt. Die Regeln für die Anordnung der Oxidationsgrade in binären und dreiteiligen Substanzen wurden oben betrachtet.
-
Dann ist es notwendig, jene Atome oder Ionen zu bestimmen, in denen sich Oxidationszustände im Verlauf der aufgetretenen Transformation verändert haben.
-
Von der linken Seite der aufgezeichneten Gleichung werden Atome oder geladene Ionen getrennt, die ihre Oxidationsstufen verändert haben. Das ist zum Ausgleich notwendig. Die Elemente werden immer durch ihre Werte angezeigt.
-
Ferner werden jene Atome oder Ionen, die während der Reaktion gebildet wurden, niedergeschrieben, durch das Vorzeichen + die Anzahl der vom Atom aufgenommenen Elektronen angegeben, – die Anzahl der negativen Teilchen, die gegeben sind. Wenn die Oxidation nach dem Reaktionsprozess reduziert wird. Das bedeutet, dass die Elektronen von einem Atom (Ion) aufgenommen wurden. Mit einer Erhöhung des Oxidationsgrades gibt das Atom (Ion) während der Reaktion Elektronen ab.
-
Die kleinste Gesamtzahl wird zuerst in die empfangenen, dann auf die dabei übertragenen Elektronen aufgeteilt, die Koeffizienten werden erhalten. Die gefundenen Zahlen sind die erforderlichen stereochemischen Koeffizienten.
-
Bestimmen Sie das Oxidationsmittel, Reduktionsmittel, die Prozesse, die während der Reaktion auftreten.
-
Die letzte Stufe ist die Anordnung der stereochemischen Koeffizienten in der betrachteten Reaktion.
Beispiel für OBR
Betrachten Sie die praktische Anwendung dieses Algorithmus auf eine spezifische chemische Reaktion.
Fe + CuSO & sub4; = Cu + FeSO & sub4 ;.
Wir berechnen die Parameter für alle einfachen und komplexen Substanzen.
Da Fe und Cu einfache Substanzen sind, ist ihr Oxidationsgrad 0. In CuSO4, dann Cu + 2, dann für Sauerstoff-2 und für Schwefel +6. In FeSO4: Fe +2, also für O-2, nach Berechnungen von S +6.
Jetzt suchen wir nach Elementen, die die Indikatoren verändern könnten, in unserer Situation werden sie Fe und Cu sein.
Da nach der Reaktion der Wert des Eisenatoms zu +2 wurde, wurden 2 Elektronen in der Reaktion freigesetzt. Kupfer änderte seine Leistung von +2 auf 0, daher nahm Kupfer 2 Elektronen. Nun bestimmen wir die Anzahl der Elektronen, die von dem Eisenatom und dem Kation des zweiwertigen Kupfers genommen und abgegeben werden. Im Laufe der Transformation werden zwei Elektronen durch das Kation des zweiwertigen Kupfers genommen, die gleiche Anzahl von Elektronen wird durch das Eisenatom aufgegeben.
In diesem Prozess ist es nicht sinnvoll, das minimale gemeinsame Vielfache zu bestimmen, da eine gleiche Anzahl von Elektronen akzeptiert und während der Transformation gegeben wird. Stereochemische Koeffizienten entsprechen auch der Einheit. Bei der Reaktion zeigen die Eigenschaften des Reduktionsmittels Eisen, während es oxidiert wird. Das Kation von zweiwertigem Kupfer wird zu reinem Kupfer reduziert, bei der Reaktion hat es den höchsten Oxidationsgrad.

Anwendung von Prozessen
Formeln für den Grad der Oxidation sollten jedem Schüler der Klasse 8-9 bekannt sein, da diese Frage in den OGE-Aufgaben enthalten ist. Alle Prozesse, die mit oxidativen, restaurativen Zeichen auftreten, spielen eine wichtige Rolle in unserem Leben. Ohne sie sind metabolische Prozesse im menschlichen Körper unmöglich.