Bestimmung von Atomen und Molekülen. Definition eines Atoms bis 1932
Ausgehend von der alten Zeit bis zur Mitte des 18. Jahrhunderts, die Wissenschaft von der Vorstellung geprägt war, dass das Atom – ein Teilchen der Materie, die nicht geteilt werden kann. Englisch Wissenschaftler und Naturwissenschaftler, und D. Dalton gab eine Definition des Atoms als kleinste Teil eines chemischen Elements. MV Lomonosov in seiner atomaren und molekularen Lehre war in der Lage, eine Definition des Atoms und Moleküls zu geben. Er war davon überzeugt, dass das Molekül, das er „Körperchen“, bestehend aus „Elementen“ genannt – Atome – und in ständiger Bewegung ist.
D. I. Mendelejew angenommen, dass diese Untereinheit Substanzen, die die materielle Welt bilden, alle seine Eigenschaften behält nur dann, wenn es zur Spaltung unterliegt. In diesem Artikel definieren wir ein Objekt als Mikrokosmos des Atoms, und untersuchen die Eigenschaften.
Hintergrund der Theorie der Atomstruktur
Im 19. Jahrhundert wird als Aussage über die Unteilbarkeit des Atoms weithin anerkannt. Die meisten Forscher glaubten, dass die Partikel aus einem chemischen Element unter irgendwelchen Umständen nicht in Atome anderer Elemente umgewandelt werden. Diese Ideen waren die Grundlage, auf der Basis wurde die Definition eines Atoms bis 1932. Im späten 19. Jahrhundert in der Wissenschaft hat grundlegende Entdeckungen gemacht worden, die diese Ansicht geändert. Zunächst einmal, im Jahr 1897 hatte der britische Physiker J. J. Thomson das Elektron entdeckt. Diese Tatsache ist grundsätzlich Wissenschaftler Ideen über untrennbaren Teil des chemischen Elements verändert.
Wie das Atom komplexe Struktur beweisen
Schon vor der Entdeckung des Elektrons , stimmen Wissenschaftler einstimmig , dass die Atome keine Ladung haben. Dann wurde festgestellt, daß Elektronen leicht von einem beliebigen chemischen Elemente unterscheiden. Sie können in einer Flamme ermittelt werden, sie Träger von elektrischem Strom sind, geben sie Substanzen während der Röntgenstrahlung.

Aber wenn die Elektronen Teil alle ohne Ausnahme sind, und negativ geladene Atome, also in einem Atom gibt es einige Partikel, die sicher sind, eine positive Ladung haben, sonst wäre Atome nicht elektrisch neutral sein. Um die Struktur des Atoms zu entwirren hat ein physikalisches Phänomen, wie Radioaktivität geholfen. Es gab die korrekte Definition des Atoms in der Physik, und dann Chemie.
Die unsichtbaren Strahlen
Französisch Physiker A. Becquerel war das erste, das Phänomen der Emission von Atomen einiger chemischer Elemente, optisch unsichtbaren Strahlen zu beschreiben. Sie ionisieren den Luftdurchgang durch das Material, wodurch eine Schwärzung der photographischen Platten. Später wurden die Curies und Rutherford gefunden , daß radioaktive Substanzen in Atome anderer chemischer Elemente umgewandelt werden (wie Uran – Neptunium).
Radioaktive Strahlung in ungleichmäßige Zusammensetzung: Alpha-Teilchen, Beta-Teilchen, Gamma-Strahlen. Somit erwies sich das Phänomen der Radioaktivität, die das Periodensystem der Elemente Partikel eine komplexe Struktur aufweist. Diese Tatsache verursacht, die der Definition des Atoms vorgenommenen Änderungen. Was Teilchen ein Atom, gegeben durch Rutherford neue wissenschaftliche Fakten erhalten? Die Antwort auf diese Frage war das vorgeschlagene scholar Kernatommodell, nach dem um die positiv geladenen Kernen Elektronen bewegen.
Contradictions Rutherford Modell
Die Theorie des Wissenschaftlers, trotz seiner herausragenden Charakter, konnte nicht objektiv das Atom definieren. Ihre Ergebnisse waren im Gegensatz zu den grundlegenden Gesetzen der Thermodynamik, wonach alle Elektronen umkreisen die Kerne verlieren ihre Energie und, wie es sein kann, früher oder später auf ihn fallen haben. Atom in diesem Fall zerstört. Dies ist eigentlich nicht der Fall, da die Chemikalien und Partikel aus dem sie hergestellt sind, für eine lange Zeit in der Natur vorkommen. Unerklärlich Atom eine solche Bestimmung auf der Grundlage der Theorie der Rutherford, sowie das Phänomen, das auftritt, wenn heiße einfachen Substanzen Gitter durch ein Beugungs verläuft. Nach Atomspektren gleichzeitig ausgebildet, um eine lineare Form aufweist. Dieser Konflikt mit dem Rutherford-Modell des Atoms, wonach das Spektrum kontinuierlich sein müßte. Gemäß den Konzepten der Quantenmechanik vorhanden Elektronen in dem Zellkern nicht als Punktobjekte gekennzeichnet sowie die Form der Elektronenwolke aufweist.

Die meisten seiner Dichte in einem bestimmten Ort des Raumes um den Kern, und wird als der Ort eines Teilchens zu einem bestimmten Zeitpunkt sein. Es wurde auch festgestellt, dass das Atom, werden Elektronen in Schichten angeordnet. Die Anzahl der Schichten kann durch die Kenntnis der Anzahl der Periode, in der das Element im Periode D. I. Mendeleeva System bestimmt werden. Zum Beispiel enthält das Phosphoratom Elektronen 15 und hat drei Energieniveaus. Der Indikator, der die Anzahl der Energieniveaus bestimmt, ist die Hauptquantenzahl genannt.
Es wurde experimentell festgestellt, dass das Energieniveau der Elektronen, die am nächsten zu dem Kern befindet, die niedrigste Energie hat. Jede Energieschale ist unterteilt in Unterebenen, und sie seinerseits auf den Orbitalen. Elektronen, die an verschiedenen Orbitale befinden haben die gleiche Form Wolken (s, p, d, f).
Basierend auf dem Vorstehenden ergibt sich, dass die Form der Elektronenwolke nicht willkürlich sein kann. Es ist streng nach der Orbital bestimmt Quantenzahl. Wir fügen auch, dass der Zustand des Elektrons in das Partikel auch durch zwei Werte bestimmt wird – magnetischer und Quantenzahl drehen. Die erste basiert auf der Schrödinger-Gleichung und charakterisiert die räumliche Orientierung der Elektronenwolke auf der Basis der Dreidimensionalität der Welt. Der zweite Indikator – die Anzahl der Spin auf sich die Drehung des Elektrons bestimmt um seine Achse oder gegen den Uhrzeigersinn.
Die Entdeckung des Neutrons
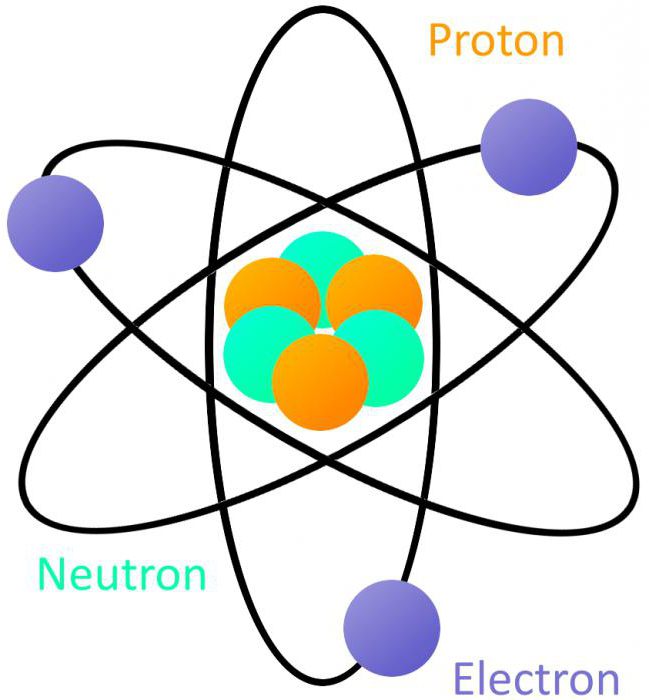
Durch die Arbeit von D. Chadwick, hielt sie im Jahr 1932 wurde eine neue Definition des Atoms in Chemie und Physik gegeben. In ihren wissenschaftlichen Experimenten bewies er, dass bei der Spaltung Polonium-Strahlung durch die Partikel, die keine Ladung, die Masse 1.008665 verursacht auftritt. Ein neues Elementarteilchen wurde das Neutron genannt. Ihre Entdeckung und Untersuchung ihrer Eigenschaften erlaubt die sowjetischen Wissenschaftler V. Gapon und Ivanenko eine neue Theorie der Struktur des Atomkerns zu schaffen, mit Protonen und Neutronen.
Nach der neuen Theorie, die Substanz der Bestimmung hatte die folgenden Atom eine Struktureinheit des chemischen Elements bilden, bestehend aus einem Kern, um es zu bewegen Protonen, Neutronen und Elektronen enthält. Die Anzahl der positiven Teilchen im Kern ist zu der Ordnungszahl des chemischen Elements im Periodensystem immer gleich.
Später Professor Schdanow in seinen Experimenten bestätigt, dass unter dem Einfluss der harten kosmischer Strahlung, Atomkerne in Protonen und Neutronen gespalten werden. Darüber hinaus hat es sich gezeigt, daß die Kräfte, die diese Elementarteilchen im Kern halten, ist es extrem energieintensiv ist. Sie wirken auf sehr kurze Distanzen (in der Größenordnung von 10 -23 cm), die so genannte Kern. Wie bereits erwähnt, durch MV Lomonosov konnte eine Definition des Atoms und das Molekül auf der Grundlage wissenschaftlicher Fakten zu ihm bekannt geben.

Zur Zeit erkannt betrachten Sie das folgende Modell: Atom besteht aus einem Kern und Elektronen um sie in einer streng definierten Bahnen bewegen – Orbitale. Elektronen, die gleichzeitig zeigen die Eigenschaften sowohl der Teilchen und Wellen, das heißt, eine Doppelnatur. Der Kern eines Atoms ist fast alle seine Masse konzentriert. Es besteht aus Protonen und Neutronen mit Kernkräften verbunden.
Ob es möglich ist, Atom zu wiegen
Es stellt sich heraus, dass jedes Atom Masse hat. Zum Beispiel ist es von Wasserstoff 1,67h10 -24 wurde sogar schwierig , wie klein diesen Wert vorstellen. Um das Gewicht des Objekts zu finden, verwenden Sie nicht die Waage, und den Oszillator, der eine ist Kohlenstoff – Nanoröhrchen. das Gewicht des Atoms und das Moleküls bequemere Menge ist das relative Gewicht zu berechnen. Es zeigt , wie oft das Gewicht eines Moleküls oder ein Atom mehr als 1/12 des Kohlenstoffatoms, die 1,66h10 -27 kg ist. Relative Atommassen sind im Periodensystem der chemischen Elemente gegeben, und sie haben keine Dimension.
Die Wissenschaftler sind sich durchaus bewusst, dass das Atomgewicht eines chemischen Elements – ist die durchschnittliche Massenzahl von Isotopen. Es scheint in der Natur eine Einheit eines chemischen Elements können unterschiedliche Massen haben. Somit wird die Ladungen des Kerns derartigen Struktur Partikel gleich.
Wissenschaftler haben herausgefunden, dass die Isotope in der Anzahl der Neutronen im Kern unterscheiden und Kerne laden sie identisch. Beispielsweise kann ein Chloratom, enthielt eine Masse 35 mit 18 Neutronen und 17 Protonen, und mit einer Masse von 37 bis 20 Protonen und 17 Neutronen. Viele chemische Elemente sind Mischungen von Isotopen. Beispielsweise einfache Substanzen, wie Kalium, Argon, Sauerstoff in seiner Zusammensetzung Atome enthalten, die 3 verschiedene Isotop.
Bestimmung der Unteilbarkeit
Es hat mehrere Interpretationen. Überlegen Sie, was mit diesem Begriff in der Chemie zu verstehen ist. Wenn die Atome eines chemischen Elementes zumindest kurzzeitig isoliert existieren, nicht dazu neigt, komplexen Teilchen zu bilden, – Molekül, dann sagen wir, dass solche Substanzen, die eine Atomstruktur aufweisen. Zum Beispiel mehrstufiger Chlorierungsreaktion von Methan. Dichlormethan, Tetrachlorkohlenstoff: Es ist allgemein in der organischen Synthesechemie für die großen Halogenderivaten verwendet. Es wird aufgespalten Chlormoleküle zu Atomen hohe Reaktivität aufweisen. Sie zerstören sigma-Bindungen in dem Methanmolekül, eine Kettensubstitutionsreaktion bereitstellt.
Ein weiteres Beispiel für einen chemischen Prozeß mit großer Bedeutung in der Industrie – die Verwendung von Wasserstoffperoxid als Desinfektionsmittel und Bleichmittel. Bestimmung von atomarem Sauerstoff als Spaltprodukt von Wasserstoffperoxid tritt sowohl in den lebenden Zellen (durch das Enzym Katalase), als auch im Labor. Atomarem Sauerstoff qualitativ durch seine hohe antioxidative Eigenschaften bestimmt und ihre Fähigkeit , Krankheitserreger zu zerstören: Bakterien, Pilze und ihre Sporen.

Wie die Kernhülle
Wir haben früher festgestellt, dass die Struktureinheit eines chemischen Elements eine komplexe Struktur aufweist. Rund um die positiv geladenen Kernteilchen drehen negative Elektronen. Der Nobelpreis Niels Bohr, basierend auf der Quantentheorie des Lichts, schaffte eine Lehre, wobei die Charakterisierung und Identifizierung von Atomen ist wie folgt: Elektronen nur an bestimmten festen Bahnen in diesem Fall nicht strahlen Energie um den Kern zu bewegen. Bohr, haben Wissenschaftler gezeigt, dass die Partikel der Mikrowelt, die Atome und Moleküle enthalten nicht die Gesetze gelten für große Körper gehorchen – Makrokosmos Objekte.
Die Struktur der Elektronenhülle von Partikeln hat in den Papieren auf Quantenphysik Wissenschaftlern wie Hund, Pauli Klechkovskii sucht worden. Da es bekannt wurde, dass die Elektronen um den Kern der Drehbewegung machen, ist nicht chaotisch, sondern auf bestimmte feste Wege. Pauli festgestellt, dass in einem einzigen Energieniveau an jeden seiner Orbitale s, p, d, f in elektronischen Zellen sein kann nicht mehr als zwei negativ geladene Teilchen von entgegengesetztem Schleuderwert + ½ und – ½.
Hundsche Regel erklärt, wie Elektronen-Orbitale mit dem gleichen Energieniveau zu füllen.
Aufbauprinzip, auch die Regel n + l, erklärt, wie gefüllte Orbitale Mehrelektronenatom (Elemente 5, 6, 7 Zyklen). Alle oben genannten Regelmäßigkeiten diente als theoretische Grundlage der chemischen Elemente durch Dmitriem Mendeleevym erstellt.
Oxidationsgrad
Es ist ein grundlegendes Konzept in der Chemie und beschreibt den Zustand eines Atoms in einem Molekül. Die moderne Definition des Oxidationsgrad der Atome ist wie folgt: die Ladung-Atomen im Molekül konditioniert, das auf den Konzepten der Grundlage berechnet wird, daß ein Molekül nur die ionische Zusammensetzung aufweist.
Die Oxidation kann durch eine ganze Zahl oder eine gebrochene Zahl, eine positive, negative oder Null-Werten ausgedrückt werden. In den meisten Atome der chemischen Elemente haben mehrere Oxidationsstufen. Beispielsweise Stickstoff ist -3, -2, 0, +1, +2, +3, +4, +5. Aber ein solches Element, wie Fluor, in allen seinen Verbindungen hat nur einen Oxidationszustand gleich -1. Wenn es eine einfache Substanz, dessen Oxidationszustand von Null dargestellt. Diese chemischen Mengen praktisch für die Einstufung von Stoffen zu verwenden und ihre Eigenschaften zu beschreiben. In den meisten Fällen ist bei der Einrichtung von Gleichungen Redoxreaktionen der Oxidationsgrad der Chemie verwendet wird.
Die Eigenschaften von Atomen
Dank der Entdeckungen der Quantenphysik, die modernen Definition des Atoms, die auf der Theorie Ivanenko und Gapon E, ergänzt durch die folgenden wissenschaftlichen Fakten beruhen. Die Struktur eines Atomkerns wird während der chemischen Reaktionen nicht verändert. Die Änderung betrifft nur die stationären Elektronenbahnen. Ihre Struktur kann auf viele physikalische und chemische Eigenschaften von Substanzen zurückgeführt werden. Wenn das Elektron eine stationäre Umlaufbahn verlässt und schreitet zu orbital mit einer höheren Energie, wie Atom angeregt genannt.

Es soll beachtet werden, dass die Elektronen nicht eine lange Zeit auf dieser Non-Core-Orbitale werden können. Rückkehr in seine stationäre Umlaufbahn emittiert die Elektronen die Energiequant. Die Untersuchung solcher Merkmale der Struktureinheiten der chemischen Elemente als Elektronenaffinität, Elektronegativität, Ionisierungsenergie hat Wissenschaftler nur erlaubt nicht das Atom als einen wesentlichen Partikel Mikrokosmos zu definieren, sondern auch erlaubte ihnen die Fähigkeit der Atom zu erklären, um einen stabilen und energetisch günstiger molekularen Zustand der Materie zu bilden, eine mögliche Folge jede Art von stabilen chemischen Bindungen zu schaffen: ionisch, kovalent-polaren und unpolaren, Donator-Akzeptor (wie eine kovalente Bindung Arten) und m etallicheskoy. Diese bestimmt die wichtigsten physikalischen und chemischen Eigenschaften von Metallen.
Es wurde experimentell festgestellt, dass die Größe eines Atoms variieren kann. Alle werden auf dem Molekül ab, in dem es enthalten ist. Durch Röntgenbeugungsanalyse kann die Entfernung zwischen den Atomen in einer chemischen Verbindung, berechnen, sowie Radius Strukturelementeinheit lernen. Besitzenden Muster der Änderung der Radien der in der Periode enthaltenen Atome oder der Gruppe der chemischen Elemente ist es möglich, ihre physikalischen und chemischen Eigenschaften vorherzusagen. Zum Beispiel Ladung in Perioden mit zunehmendem Atomkern ihre Radius Abnahme ( „compression atom“) und damit die metallischen Eigenschaften der Verbindungen schwächen, und nichtmetallische amplifiziert.
Somit ist die Kenntnis der Struktur des Atoms kann die physikalischen und chemischen Eigenschaften aller Elemente genau bestimmen, in dem Periodensystem der Elemente enthalten.














