Protein: Struktur und Funktion. Eigenschaften von Proteinen
Wie bekannt ist, Proteine – die Grundlage für die Entstehung des Lebens auf unserem Planeten. Nach der Theorie von Oparin-Haldane war Coacervat Tropfen, die aus Molekülen von Peptiden, hat es die Grundlage der Entstehung der Lebewesen werden. Dies ist ohne Zweifel, da die Analyse der inneren Struktur eines Mitglieds der Biomasse zeigt, dass diese Substanzen haben alles: Pflanzen, Tiere, Mikroorganismen, Pilze, Viren. Und sie sind sehr vielfältig in der Natur und hochmolekularen.
Die Namen dieser vier Strukturen, sie sind gleichbedeutend:
- Proteine;
- Proteine;
- Polypeptide;
- Peptide.

Proteinmoleküle
Ihre Zahl ist wirklich unberechenbar. In diesem Fall können alle der Proteinmoleküle in zwei Hauptgruppen unterteilt werden:
- Einfach – bestehen nur aus Aminosäuresequenzen, die durch Peptidbindungen verbunden sind;
- Komplex – Struktur und Struktur eines Proteins sind durch die zusätzlichen protolytischen (prothetischen) Gruppen gekennzeichnet, die auch als Co-Faktoren.
In diesem Fall haben die komplexen Moleküle auch ihre eigene Klassifizierung.
Gradation komplexe Peptide
- Glykoproteine – sind eng Protein und Kohlenhydratverbindungen verbunden. Die Struktur des Moleküls prosthetische Gruppen Mucopolysaccharide gewebt.
- Lipoproteine – eine komplexe Verbindung von Proteinen und Lipiden.
- Metalloproteine – als prosthetische Gruppe sind die Metallionen (Eisen, Mangan, Kupfer und andere).
- Nukleoproteine – Feedback-Protein und Nukleinsäuren (DNA, RNA).
- Fosfoproteidy – Konformation des Proteins und ein Rest der Phosphorsäure.
- Chromoproteids – sehr ähnlich Metalloproteine, aber ein Element, das Teil der prosthetischen Gruppe ist, ist ein Farbkomplex (rot – Hämoglobin, grün – Chlorophyll, und so weiter).
Jede Gruppe diskutiert die Struktur und die Eigenschaften von Proteinen sind unterschiedlich. Die Funktionen, die sie durchführen, und wird in Abhängigkeit von der Art des Moleküls variieren.

Die chemische Struktur von Proteinen
Aus diesem Gesichtspunkt Proteinen – eine langen, massiven Kette der Aminosäurereste spezifische Bindungen genannt Peptid miteinander verbunden ist. Von den Seitenstrukturen Säuren abgehen Zweig – Radikale. Diese Struktur des Moleküls wurde von E. Fischer am Anfang des XXI Jahrhunderts entdeckt.
Später, Proteine, Struktur und Funktion von Proteinen wurden im Detail untersucht. Es wurde deutlich, daß die Aminosäuren, welche die Peptidstruktur, insgesamt 20, aber sie können daher auf verschiedene Weise kombiniert werden. Daraus ergibt sich die Vielfalt der Polypeptid-Strukturen. Darüber hinaus wird in dem Prozess des Lebens und die Erfüllung ihrer Aufgaben Proteine sind in der Lage, eine Reihe von chemischen Umwandlungen zu unterziehen. Als Ergebnis ändern sie die Struktur, und es gibt eine ganze neue Art der Verbindung.
Um die Peptid-Bindung zu brechen, dh Proteinstruktur der Ketten unterbrechen muß sehr strenge Bedingungen (hohe Temperaturen, sauren oder alkalischer Katalysator) gewählt werden. Dies ist aufgrund der hohen Festigkeit der kovalenten Bindungen im Molekül, und zwar in der Peptidgruppe.

Detektion der Proteinstruktur im Labor durchgeführt wird , die Biuret – Reaktion unter Verwendung von – Wirkung auf Polypeptid frisch gefälltes Hydroxid, Kupfer (II). Der Komplex der Peptidgruppe und Kupferionen liefert eine hellvioletten Farbe.
Es gibt vier grundlegende strukturelle Organisation, von denen jeder seine eigenen Eigenschaften der Struktur von Proteinen hat.
Organisationsebenen: die Primärstruktur
Wie oben erwähnt, wird das Peptid – ohne dass sie eine Sequenz von Aminosäureresten mit Einschlüssen, Co-Enzymen oder. So nennen dies die primäre Struktur des Moleküls, was natürlich ist, natürlich ist es die wahren Aminosäuren durch Peptidbindungen verbunden ist, und sonst nichts. Das heißt, das Polypeptid lineare Struktur. In dieser besonderen Struktur der Proteine dieser Art -, dass diese Kombination von Säuren ist entscheidend für die Wahrnehmung der Aufgaben des Proteinmoleküls. Dank dieser Eigenschaften ist möglich, nicht nur Peptid zu identifizieren, sondern auch die Eigenschaften und die Rolle eines völlig neuen, noch unentdeckten vorherzusagen. Beispiele für Peptide, natürliche Primärstruktur, – Insulin, Pepsin, Chymotrypsin und andere.
sekundäre Konformation
Struktur und Eigenschaften von Proteinen in dieser Kategorie etwas variieren. Eine solche Struktur kann anfänglich von der Art gebildet werden, oder wenn die Primär Hydrolyse starren, Temperatur oder anderen Bedingungen unterworfen.
Diese Konformation hat drei Sorten:
- Glatte, regelmäßige, stereoregulärem Spulen aus den Aminosäureresten aufgebaut ist, die um den Kern Verbindungsachse verdreht sind. Nur zusammengehalten durch Wasserstoffbindungen , die zwischen Sauerstoff – Gruppe von einem Peptid und dem anderen Wasserstoff. Wobei die Struktur korrekt aufgrund der Tatsache, daß die Windungen jeder Ebene 4 gleichmäßig wiederholt. Eine solche Struktur kann sowohl für Linkshänder und pravozakruchennoy sein. Aber in den meisten bekannten Proteinen rechtsdrehende Isomer vorherrscht. Eine solche Konformation alpha-Strukturen genannt.
- Die Zusammensetzung und die Struktur des folgenden Typs Protein unterscheidet sich von der vorhergehenden dadurch, dass die Wasserstoffbrückenbindungen nicht zwischen der stehenden nebeneinander auf einer Seite des Rests des Moleküls und zwischen im wesentlichen entfernt wird, wobei bei einer ausreichend großen Abstand gebildet. Aus diesem Grunde wird die gesamte Struktur hügelig, gewundenen Schlange Polypeptidketten. Es ist ein Merkmal, das Protein sein sollte. Die Struktur der Aminosäuren der Zweige soll wie die von Glycin oder Alanin so kurz sein, zum Beispiel. Diese Art der Sekundär Konformation ist für ihre Fähigkeit, Beta-Blätter genannt werden, aneinander zu haften, wenn die Bildung der Gesamtstruktur.
- Zugehörig zu der dritten Typ Proteinstruktur wie die Biologie bezeichnet komplexen raznorazbrosannye, ungeordnete Fragmente, die keine Stereoregularität und in der Lage, die Struktur unter dem Einfluß von äußeren Bedingungen zu modifizieren.
Beispiele für Proteine, die Sekundärstruktur von Natur aus haben, werden nicht offenbart.

tertiäre Bildung
Dies ist eine ziemlich komplexe Konformation, mit dem Namen „globule“. Was ist ein Protein? Die Struktur wird auf der Basis der Sekundärstruktur, sondern hat neue Arten von Wechselwirkungen zwischen den Atomen der Gruppen, und das gesamte Molekül wie Falten, geführt, um die Tatsache so, dass die hydrophilen Gruppen in Globuli und hydrophoben gerichtet – out.
Dies erklärt auch die Ladung des Proteinmoleküls in Wasser kolloidale Lösungen. Was sind die Arten von Wechselwirkungen gibt es?
- Wasserstoffbrücken – bleiben unverändert zwischen den gleichen Teilen wie in der Sekundärstruktur.
- Die hydrophobe (hydrophilen) Wechselwirkung – entstehen , wenn in Wasser gelöst Polypeptid.
- Ionische Anziehung – raznozaryazhennymi zwischen den Aminosäureresten (Radikal) Gruppen gebildet.
- Kovalente Wechselwirkungen – Cystein-Molekül, oder besser gesagt, ihr Schwanz – kann zwischen den spezifischen sauren Stellen gebildet werden.
Somit kann die Zusammensetzung und Struktur von Proteinen, die eine Tertiärstruktur, wie ein durch verschiedene Arten von chemischen Wechselwirkungen Globuli Polypeptidketten aufgerollt in, Bindung und Stabilisierung ihrer Konformation beschrieben. Beispiele für solche Peptide: fosfoglitseratkenaza, tRNA, alpha-Keratin, Seidenfibroin und andere.
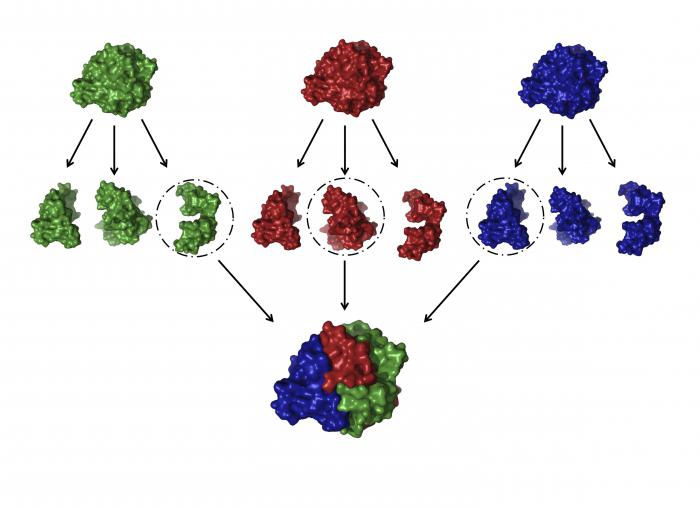
Die Quartärstruktur
Dies ist einer der schwierigsten der Kügelchen, die Proteine bilden. Die Struktur und Funktion von Proteinen eines solchen Plans ist sehr vielseitig und spezifisch.
Was ist diese Konformation? Es ist ein paar (manchmal Dutzende) von großen und kleinen Polypeptidketten, die unabhängig voneinander ausgebildet sind. Aber dann, aufgrund der gleichen Wechselwirkungen, die wir für die Tertiärstruktur dieser Peptide betrachtet werden verdreht und miteinander verflochten. Somit komplexe Konformationsänderung Globuli erhalten, die Metallatome und Lipidgruppen und Kohlenhydrat enthalten. Beispiele für solche Proteine: DNA-Polymerase, Tabak Virus Hüllprotein, Hämoglobin und andere.

Alle Peptidstrukturen wir haben ihre eigenen Methoden zur Identifizierung im Labor diskutiert haben, die auf den gegenwärtigen Möglichkeiten der Verwendung von Chromatographie, Zentrifugation, Elektronen- und Lichtmikroskopie und hohe Computertechnologien.
Funktionen
Die Struktur und Funktion von Proteinen sind eng miteinander korrelieren. Das heißt, jedes Peptid eine Rolle spielt, die einzigartig und spezifisch ist. Es gibt auch diejenigen, die in der Lage sind, in einer lebenden Zelle, mehr bedeutenden Transaktionen durchzuführen. Aber es kann zusammengefasst werden, wie die grundlegenden Funktionen der Proteinmoleküle in den Körpern von Lebewesen zum Ausdruck bringen:
- Bereitstellung von Datenverkehr. Lige Organismen oder Organellen, oder bestimmte Arten von Zellen sind in der Lage Bewegung, Schnitte, Bewegungen. Dieses Protein wird bereitgestellt, deren Struktur der Motorvorrichtung, die Teil: Cilien, Flagellen, Cytoplasmamembran. Wenn wir über die Unfähigkeit zur Verschiebung der Zellen sprechen, können die Proteine in ihre Reduktion (Myosin Muskel) beitragen.
- Nutritional oder Backup-Funktion. Es ist eine Ansammlung von Proteinmolekülen in Eizellen, Embryonen und Pflanzensamen für die weiteren Füllung fehlenden Nährstoffe. Nach der Spaltung der Peptide produzieren Aminosäuren und biologisch aktive Substanzen, die für die normale Entwicklung von lebende Organismen notwendig sind.
- Die Energiefunktion. Neben Kohlenhydraten zwingt der Körper kann und Proteine produzieren. In dem Zerfall von 1 g des Peptid 17,6 kJ Nutzenergie in Form von Adenosintriphosphat (ATP) gelöst, die sich auf lebenswichtige Prozesse ausgegeben wird.
- Signal und regulatorische Funktion. Sie besteht darin, eine sorgfältige Überwachung der laufenden Prozesse Durchführung und die Übertragung von Signalen von Zelle zu Geweben, von ihnen zu den Behörden, von den letzten auf das System und so weiter. Ein typisches Beispiel ist Insulin, das streng die Zahl der Blutzucker aufzeichnet.
- Rezeptorfunktion. Es wird durch eine Änderung der Konformation des Peptids mit einer Seite des Membran und Eingriff mit dem anderen Ende der Restrukturierung erreicht. Wenn dies der Fall ist und die Signalübertragung und die erforderlichen Informationen. Die meisten dieser Proteine sind in der zytoplasmatischen Membran von Zellen eingebettet und führen eine strenge Kontrolle über das gesamte Material hindurchströmende. alarmieren Sie auch auf die chemischen und physikalischen Veränderungen in der Umwelt.
- Transportfunktion des Peptide. Es erfolgt Feeds Proteine und Transportproteine. Ihre Aufgabe ist es offensichtlich – Transport wünschenswert Moleküle an die Stellen mit einer niedrigen Konzentration der hohen Teile. Ein typisches Beispiel ist der Transport von Sauerstoff und Kohlendioxid von den Organen und Geweben des Protein Hämoglobin. Sie erreicht haben auch die Lieferung von Verbindungen mit einem niedrigen Molekulargewicht durch die Membran in die Zelle.
- Strukturfunktion. Einer der wichtigsten von denen, die Protein führt. Die Struktur der Zellen und ihre Organellen Peptide zur Verfügung gestellt. Sie sind ähnlich zu dem Rahmen definieren Form und Struktur. Darüber hinaus unterstützen sie es auch, und ggf. ändern. Daher ist für das Wachstum und die Entwicklung aller Organismen essentieller Proteine in der Nahrung lebt. Solche Peptide umfassen Elastin, Tubulin, Kollagen, Aktin und andere Keratin.
- Die katalytische Funktion. Ihre Durchführung Enzyme. Zahlreich und vielfältig, beschleunigen sie alle chemischen und biochemischen Reaktionen im Körper. Ohne ihre Beteiligung gewöhnlichen Apfel im Magen nur zu verdauen für zwei Tage wäre in der Lage, ist es wahrscheinlich, die gleichzeitig biegen. Unter der Wirkung von Katalase, Peroxidase und anderen Enzymen, findet dieser Prozess in zwei Stunden. Im Allgemeinen ist es dank dieser Rolle Protein Anabolismus und Katabolismus durchgeführt, das heißt, Kunststoff und Energiestoffwechsel.

Die Schutzfunktion
Es gibt mehrere Arten von Bedrohungen, von denen Proteine entwickelt werden, um den Körper zu schützen.
Zur einem chemischen Angriff traumatische Reagenzien, Gas, Moleküle, Substanzen unterschiedliches Wirkungsspektrums. Peptide ist in der Lage, mit ihnen in einer chemischen Reaktion in Eingriff zu bringen, in eine harmlose Form überführt oder einfach neutralisieren.
Zweitens ist die physische Bedrohung aus der Wunde -, wenn das Protein in der Zeit Fibrinogen in Fibrin nicht an der Stelle der Verletzung umgewandelt wird, wird das Blut nicht gerinnen, und somit wird Verstopfung auftreten. Dann, im Gegenteil, es muss Plasmin Peptid, saugte Gerinnsel und die Durchgängigkeit des Gefäßes wieder herzustellen.
Drittens ist die Bedrohung der Immunität. Struktur und den Wert der Proteine, die die Immunabwehr bilden, sind äußerst wichtig. Antikörper, Immunglobuline, Interferone – sind wichtige und bedeutende Elemente des Lymph- und Immunsystem. Fremdpartikel, böswilliges Molekül, toten Zellen oder ein Teil der gesamten Struktur wird zu einer sofortigen Untersuchung durch die Peptid-Verbindung unterzogen. Deshalb kann eine Person besitzen, ohne die Hilfe von Drogen jeden Tag selbst vor einer Infektion zu schützen und einfache Viren.
physikalische Eigenschaften
Die Struktur der Protein-Zellen ist sehr spezifisch und hängt von der Funktion. Aber die physikalischen Eigenschaften von Peptiden sind ähnlich und können auf die folgenden Merkmale reduziert werden.
- Gewicht Moleküle – bis 1000000 Dalton.
- In wässriger Lösung bilden das kolloidale System. Es Struktur erhält aufzuladen Lage ist, auf die Acidität des Mediums variieren.
- Wenn zu harten Bedingungen ausgesetzt (Strahlung, Säure oder Alkali, die Temperatur, etc.) sind in der Lage auf andere Ebenen Konformationen zu bewegen, d.h. denaturieren. Der Prozess in 90% der Fälle unumkehrbar. Allerdings gibt es eine Rückverschiebung – Renaturierung.
Diese grundlegenden Eigenschaften der physikalischen Eigenschaften der Peptide.