Sauerstoff-Formel. Periodensystem – Sauerstoff
Chemisches Element Sauerstoff in der zweiten Periode VI-ten Hauptgruppe veralteter eine kurze Version des Periodensystems gespeichert. Nach den neuen Numerierungsstandards – ist der 16. Gruppe. Die entsprechende Entscheidung wurde von der IUPAC 1988 hergestellt. Sauerstoff als einfache Substanz der Formel – O 2. Betrachten wir seine wichtigsten Eigenschaften, die Rolle in der Natur und Wirtschaft. Wir beginnen mit einer Beschreibung der gesamten Gruppe des Periodensystems, die durch Sauerstoff geleitet wird. Element unterscheidet sich von seinem Kongenere das Chalkogen aufweist, und Wasser von Wasserstoff verschieden ist die Verbindungen von Schwefel, Selen und Tellur. Die Erklärung aller Merkmale zu finden ist, nur über die Struktur und die Eigenschaften des Atoms zu lernen.
Chalkogene – ähnliche Elemente Sauerstoff
Ähnliche Eigenschaften der Atom bilden eine einzige Gruppe im Periodensystem. Sauerstoff wird von der Familie von Chalcogene angeführt, unterscheidet sich aber von ihnen in einer Reihe von Eigenschaften.
Die Atommasse von Sauerstoff – die Vorfahre Gruppe – ist 16 ein. .. E m Chalcogenverbindungen mit der Bildung von Wasserstoff und Metallen weist ihre normale Oxidationsstufe -2. Zum Beispiel aus Wasser (H 2 O) Oxidationszahl von Sauerstoff -2.
Zusammensetzung typischer Wasserstoff Chalkogen – Verbindungen der allgemeinen Formel: H 2 R. Die Auflösung dieser Stoffe gebildet Säure. Nur Wasserstoffbrückenbindung Sauerstoff – Wasser – hat besondere Eigenschaften. Nach den Erkenntnissen von Wissenschaftlern, diese Substanz ist ungewöhnlich und sehr schwache Säure und eine sehr schwache Base.
Schwefel, Selen und Tellur haben typische positive Oxidationsstufe (+4, +6) in Verbindungen mit Sauerstoff und anderen Nichtmetallen mit hohen Elektronegativität (EO). Zusammensetzung Chalkogen Oxide reflektieren die allgemeine Formel: RO 2, RO 3. Sie haben eine Zusammensetzung entsprechenden Säuren: H 2 RO 3, H 2 RO 4.
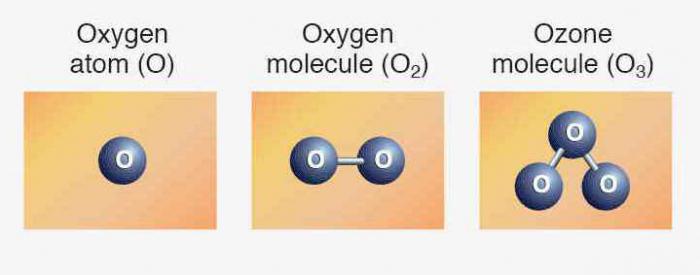
Elemente entsprechen einfache Substanzen: Sauerstoff, Schwefel, Selen, Tellur und Polonium. Die ersten drei Mitglieder zeigen metallische Eigenschaften. Oxygen Formula – Über 2. Allotrope Modifikation des gleichen Elements – Ozon (O 3). Beide Versionen sind Gase. Schwefel und Selen – Solidee Nichtmetalle. Tellur – metalloiden Stoff, ein Leiter für elektrischen Strom, Polonium – Metall.
Sauerstoff – das häufigste Element
Der Gesamtgehalt der Atome des Elements in der Erdkruste ist etwa 47% (nach Gewicht). Sauerstoff wird in freier Form oder als Teil von mehreren Verbindungen gefunden. Einfache Substanz, deren Formel aus O 2 in der Zusammensetzung der Atmosphäre, die zusammen 21% Luft (bezogen auf das Volumen). Molekularer Sauerstoff in Wasser gelöst wird, ist es zwischen den Bodenpartikeln.
Wir wissen bereits, dass es eine andere Art von Existenz des gleichen chemischen Elements in Form einer einfachen Substanz. Diese Ozon – Gas bei etwa 30 km von der Oberflächenschicht bilden, die oft als Ozon-Bildschirm. Gebundener Sauerstoff tritt in die Wassermoleküle in den vielen Gesteinen und Mineralien, organische Verbindungen.
Struktur Sauerstoffatom
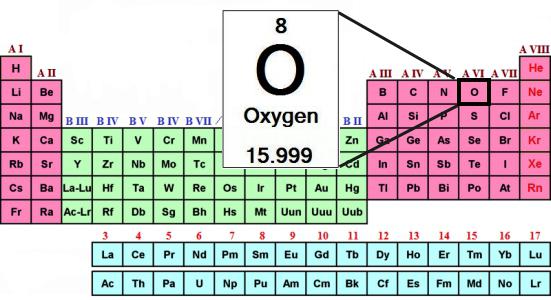
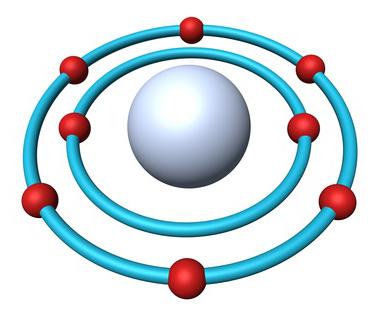
Periodensystem enthält alle Informationen über Sauerstoff:
- Die Seriennummer des Elements – 8.
- Kernladung – 8.
- Die Gesamtzahl der Elektronen – 8.
- Elektronischer Sauerstoff Formel – 1s 2s 2 2 2p 4.
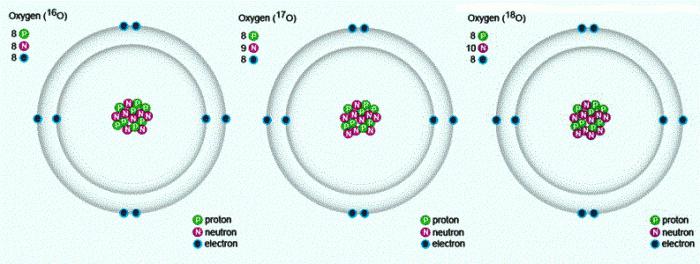
In der Natur gibt es drei stabile Isotope, die die gleiche Sequenznummer in dem Periodensystem, eine identische Zusammensetzung von Protonen und Elektronen, aber eine unterschiedliche Anzahl von Neutronen haben. Isotopen werden durch das gleiche Symbol bezeichnet – O. Für Vergleichsdiagramm, das die Zusammensetzung der drei Sauerstoffisotopen zeigt:
Eigenschaften von Sauerstoff – ein chemisches Element
Auf 2P sublevel Atom hat zwei ungepaarten Elektronen, die das Auftreten von Oxidation erklärt -2 und +2. Zwei gepaarte Elektronen nicht trennen, um den Grad der Oxidation zu vier, wie in Schwefel erhöht und weitere Chalkogenide. Die Grund – Mangel an freier Unterschicht. Daher tritt die Verbindungen des chemischen Elements nicht Sauerstoff Valenz und Oxidationszustand gleich Gruppennummer in der Kurzversion des Periodensystems (6) aufweisen. Durchschnittliche Oxidationszahl -2 für ihn.
Nur mit Fluorverbindungen weist Sauerstoff untypisch positiven Oxidationszustand von +2 für ihn. EO-Wert von zwei unterschiedlichen Stärken Nichtmetalle: EA (D) = 3,5; EE (F) = 4. Als elektro Element, Fluor stärker seine Valenzelektronen behält und zieht die Teilchen zu einem externen Energieniveau des Sauerstoffatoms. Daher wird bei der Reaktion mit Fluor ist es Sauerstoffreduktionsmittel verlieren Elektronen.
Sauerstoff – eine einfache Substanz
D. Englisch Forscher Priestley im Jahr 1774 im Zuge von Experimenten Gas durch die Zersetzung von Quecksilberoxid identifiziert. Zwei Jahre zuvor, die gleiche Substanz in reiner Form war K. Scheele. Nur ein paar Jahre später fand der Französisch Chemiker Antoine Lavoisier, dass für Gas ein Teil der Luft, und studierte Eigenschaften. Chemischer Sauerstoff Formel – O 2. Reflektieren Aufzeichnungs Zusammensetzung der Materie Elektronen Teilnahme an der Bildung einer nicht-polare kovalente Bindung – O O ::. Ersetzen jedes Bindungselektronenpaar mit einer Zeile: O = O. Solche Sauerstoff Formel zeigt deutlich, dass die Atome im Molekül durch zwei gemeinsame Elektronenpaare verbunden sind.

Einfache Berechnungen durchführen und bestimmen , was die relative Molekülmasse von Sauerstoff ist: Mr (O 2) = Ar (O) x 2 = 16 x 2 = 32 Zum Vergleich: (. Air) Mr = 29 Oxygen Chemische Formel unterscheidet sich von Ozon ein Sauerstoffatom. Daher Mr (O 3) = Ar (O) x 3 = 48. Ozon in Sauerstoff ist 1,5 mal schwerer.
physikalische Eigenschaften
Sauerstoff – ein Gas, ohne Farbe, Geschmack und Geruch (bei Standardtemperatur und Druck gleich dem Atmosphärendruck). Die Substanz ist etwas schwerer als Luft; löslich in Wasser, jedoch in geringen Mengen. Schmelzpunkt Sauerstoff ist negativ und beträgt -218,3 ° C. Der Punkt, an dem flüssigen Sauerstoff wieder in Gas umgewandelt wird, – ist seine Siedetemperatur. Für O 2 -Moleküle Wert dieser physikalischen Größe erreicht -182,96 ° C Der flüssige und fester Sauerstoff wird zu einer hellblauen Farbe.
Erster Sauerstoff im Labor
Beim Erhitzen sauerstoffhaltigen Substanzen wie Kaliumpermanganat, ist ein farbloses Gas zugeordnet, die in einem Kolben oder Röhrchen gesammelt werden kann. Wenn Sie in reiner Sauerstoff Fackel machen, brennt es heller als in der Luft. Zwei andere Laborverfahren zur Herstellung von Sauerstoff – die Zersetzung von Wasserstoffperoxid und Kaliumchlorat (Kaliumchlorat). Betrachten wir die Schaltungsvorrichtung, die für die thermische Zersetzung verwendet wird.
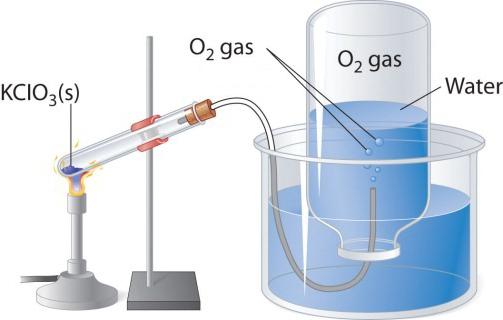
In einem Teströhrchen oder einen Rundkolben, notwendig ist, ein wenig Kaliumchlorat zu gießen, den Anschlag mit einem Gasauslaßrohr schließen. Sein gegenüberliegendes Ende sollte in der Flasche des Kopf invertiert gesendet (unter Wasser) wird. Der Hals sollte mit Wasser gefüllt in einem Glas oder eine Form verzichtet werden. Beim Erhitzen Sauerstoff wird aus dem Rohr Chloratsalz freigesetzt. Da es um das Dampfrohr in den Kolben eintritt, verdrängt Wasser aus ihr. Wenn die Lampe mit Gas, seine geschlossene Unterwasser zugestöpselt und invertiert gefüllt ist. Erhalten in diesem Laborversuch kann Sauerstoff verwendet werden, um die chemischen Eigenschaften der einfachen Substanz zu studieren.
Verbrennung
Wenn das Labor in Sauerstoff die Verbrennung von Substanzen führt, ist es notwendig, mit Brandschutzbestimmungen zu kennen und einzuhalten. Wasserstoff wird sofort in der Luft verbrannt wird, gemischt mit Sauerstoff in einem Verhältnis von 2: 1, ist es explosiv. Verbrennungs Substanzen in reinem Sauerstoff ist viel intensiver als in der Luft. Dies wird durch das Phänomen der Luftzusammensetzung erläutert. Sauerstoff in der Atmosphäre ist wenig mehr als 1,5 Teile (21%). Combustion – eine Reaktions Substanz mit Sauerstoff, und was zu unterschiedlichen Produkten, vor allem Oxide von Metallen und Nichtmetallen. Oxidierende Mischung von O 2 mit brennbaren Stoffen, zusätzlich können die erhaltenen Verbindungen toxisch sein.
Verbrennungs herkömmliche Kerze (oder Streichhölzer) durch die Bildung von Kohlendioxid begleitet wird. Der folgende Versuch kann zu Hause durchgeführt werden. Wenn der Stoff unter einem Glas oder einer großen Tasse zu verbrennen, wird die Verbrennung aufhören, sobald der gesamte Sauerstoff verbraucht wird. Stickstoff nicht Atmung und Verbrennung unterstützen. Kohlendioxid – Oxidationsprodukt – reagiert nicht mehr mit Sauerstoff. Transparent Kalkwasser kann das Vorhandensein von erkennen Kohlendioxid beim Verbrennen Kerze. Wenn Verbrennungsprodukte durch das Calciumhydroxid passieren, wird die Lösung trüb. Chemische Reaktion tritt zwischen dem Kalkwasser und Kohlendioxid, erhalten unlösliches Calciumcarbonat.

Herstellung von Sauerstoff im industriellen Maßstab
Das billigste Verfahren, bei der 2 – Moleküle frei von Luft O erhalten wird, nicht mit der Durchführung chemische Reaktionen in Verbindung gebracht. In der Industrie, beispielsweise in Stahlwerken, die Luft mit niedriger Temperatur und hohem Druck verflüssigt. Solche große atmosphärische Komponenten wie Sauerstoff und Stickstoff, siedet bei verschiedenen Temperaturen. Trennen Sie das Luft-Gemisch mit allmählichem Erwärmen auf Raumtemperatur. Zuerst Stickstoffmoleküle unterscheiden, und dann Sauerstoff. Das Verfahren zur Trennung basierend auf verschiedenen physikalischen Eigenschaften von einfachen Substanzen. Formel einfache Substanz von Sauerstoff ist die gleiche wie vor der Kühlung und Verflüssigung von Luft, – O 2.
Als Ergebnis wird ein Teil der Elektrolysereaktionen auch Sauerstoff, über die entsprechende Elektrode gesammelt. Gasbedarf von Industrie, Bauunternehmen in großen Mengen. Sauerstoffbedarf wächst stetig, vor allem braucht es die chemische Industrie. Gespeicherte Produktgas für industrielle und medizinische Zwecke in Stahlzylindern, ausgestattet mit einer Markierung. Ein Sauerstofftank in blau oder blau gefärbt es von anderen verflüssigten Gasen zu unterscheiden – Stickstoff, Methan, Ammoniak.

Chemische Berechnungen basierend auf Formeln und Gleichungen von Reaktionen mit O 2 -Moleküle
Der Zahlenwert der Molmasse von Sauerstoff fällt zusammen mit einer anderen Menge – relative Molekularmasse. Nur im ersten Fall gibt es Einheiten. M (O 2) = 32 g / mol: kurz Formel Sauerstoff Substanz und sein Molekulargewicht sind als geschrieben werden. Unter normalen Bedingungen Mol jedem Gasvolumen entspricht 22,4 Liter. Folglich 1 Mol O 2 – beträgt 22,4 Liter Substanz 2 Mol O 2 bis 44,8 Liter. Nach der Gleichung der Reaktion zwischen Wasserstoff und Sauerstoff zu erkennen ist, dass 2 Mol Wasserstoff und ein Mol Sauerstoff reagieren:
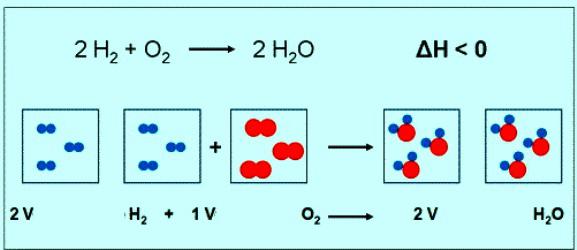
Wenn das Spiel der Umsetzung von 1 Mol Wasserstoff wird die Sauerstoffmenge von 0,5 mol • 22,4 l / mol = 11,2 Litern.
Die Rolle von O 2 -Moleküle in der Natur und des menschlichen Lebens
Der Sauerstoff von lebenden Organismen auf der Erde verbraucht, und ist in der Zirkulation von Substanzen über 3 Milliarden Jahren beteiligt. Dies ist die wichtigste Substanz für die Atmung und Stoffwechsel kann es Nährstoffe Moleküle vom Körper benötigt Energie synthetisiert zersetzen. Sauerstoff wird in der Welt ständig verbraucht, aber seine Reserven werden durch die Photosynthese wieder aufgefüllt. Russische Wissenschaftler K. Timirjasews angenommen, dass aufgrund dieses Prozesses gibt es noch das Leben auf unserem Planeten.

Groß ist die Rolle des Sauerstoffs in der Natur und Wirtschaft:
- während der Atmung lebenden Organismen absorbiert;
- in den Reaktionen der Photosynthese in Pflanzen beteiligt ist;
- ein Teil des organischen Moleküls;
- Zerfallsprozesse, Fermentierung, Roste auftreten mit der Teilnahme von Sauerstoff als Oxidationsmittel dient;
- für die Synthese von organischen Produkten verwendet.
Die verflüssigte Sauerstoff-Flaschen sind für das Schneiden und Schweißen von Metallen bei hohen Temperaturen verwendet. Diese Prozesse werden in den Maschinenbau-Anlagen durchgeführt, in der Transport- und Bauunternehmen. Für die Arbeit unter Wasser, unter der Erde, in großer Höhe in einem Vakuum müssen die Menschen auch das O 2 -Molekül. Sauerstoffflaschen werden in der Medizin verwendet , um die Zusammensetzung der Luft von Menschen eingeatmet zu bereichern , die krank sind. Gas für medizinische Zwecke, durch die fast völlige Fehlen von technischen Verunreinigungen gekennzeichnet, Geruch.

Sauerstoff – das perfekte Oxidations
Bekannte Sauerstoff-Verbindung mit allen chemischen Elementen des Periodensystems, mit Ausnahme der ersten Vertreter der Familie der Edelgase. Viele Substanzen reagieren direkt mit Sauerstoffatomen, ohne Halogene, Gold und Platin. Von großer Bedeutung sind die Phänomene Sauerstoff beteiligt, das durch die Freisetzung von Licht und Wärme begleitet werden. Solche Verfahren sind in der Heimat und der Industrie weit verbreitet. Die Metallerze Reaktion mit Sauerstoff genannt abzufeuern. Vorgemahlenen Erz wird mit Sauerstoff angereicherte Luft vermischt. Bei hohen Temperaturen sind die Rückgewinnung von Metallen aus Sulfid zu einfachen Substanzen. So Eisen erhalten und einige NE-Metalle. Das Vorhandensein von reinem Sauerstoff erhöht die Geschwindigkeit der Produktionsprozesse in den verschiedenen Zweigen der Chemie, Technik und Metallurgie.
Das Aussehen eines billigen Verfahren für Sauerstoff aus der Luft durch die Trennung in seine Komponenten bei niedriger Temperatur produziert, hat die Entwicklung von vielen Bereichen der industriellen Produktion stimuliert. Chemists glaubt Molekül O 2 und O – Atomen ideal Oxidationsmittel. Dies sind natürliche Materialien, sie sind ständig in der Natur erneuert, die Umwelt nicht verschmutzen. Darüber hinaus chemische Reaktionen mit Sauerstoff oft mit einer Synthese eines weiteren natürlichen und sicheren Produkts beenden – Wasser. Die Rolle von O 2 bei der Entfernung von toxischem industriellem Abwasser von Verunreinigungen. Außerdem wird Sauerstoff zur Desinfektion seiner allotropen Modifikationen verwendet – Ozon. Diese einfache Substanz besitzt eine hohe Oxidationsaktivität. Wenn Wasser Ozonierung Schadstoffe zersetzen. Ozon ist auch schädliche Wirkung auf pathogene Mikroflora.