Kaliumthiocyanat – eine toxische Substanz in der analytischen Chemie
Kaliumthiocyanat (in der modernen IUPAC-Nomenklatur – Kaliumthiocyanat) – Kristalle ohne Farbe und Geruch; in fein acquire weiß geteilt. Der Stoff hat einen bitteren Geschmack scharf, ist giftig. Kaliumthiocyanat ist sehr gut löslich in vielen Lösungsmitteln, wie Wasser, Ethanol und Amylalkohol.
Empfang
Die Verbindung wurde nur durch chemische Mittel, unterscheidet sie von natürlichen Quellen (Blut und Speichel von Menschen) – ist extrem teuer. Um das Kaliumthiocyanat, notwendig zu mischen Lösungen von Ammoniumthiocyanat und Kaliumhydroxid (common name – Kaliumhydroxid) zu synthetisieren.
Das Experiment wurde unter einer Haube durchgeführt, da das Ammoniak Verätzungen und Vergiftungen verursachen kann; dann Filtration der gereinigten Lösung wurde eingedampft, und der Rückstand Kristalle der erwünschten Substanz zu ergeben. Wenn das Ausgangsprodukt bis siebzig Prozent und ausreichend Ammoniumthiocyanat reine Probe ist dieses Verfahren sehr effektiv.

Ein anderer Weg ist Schwefel mit legierten Zyankali, aber ein solches Verfahren zur Herstellung von Kaliumthiocyanat ist ziemlich gefährlich wegen der hohen Toxizität von Cyanid.
Anwendung
Anwendbar Kaliumthiocyanat, Derivate davon, und Lösungen mit unterschiedlichen Konzentrationen von einigen Sektoren. Zum Beispiel:
- Textilindustrie.
- Fotografischen Film.
- Organische Synthese.
- Analytische Chemie.
Einsatzbereiche

- In der Textilindustrie. Kaliumthiocyanat-Lösung wird zum Ätzen von Geweben verwendet werden, z.B. – Seide, während der Verarbeitung und Handhabung der ursprünglichen Eigenschaften des Materials zu bewahren.
- In der organischen Synthese. Von Kalium-Thiocyanat synthetisierte einige organischen Substanzen, wie Thioharnstoff, ein synthetisches Senföl und verschiedene Farbstoffe. Auch mit Hilfe anderer Thiocyanate erhalten, beispielsweise – Kupferthiocyanat-2.
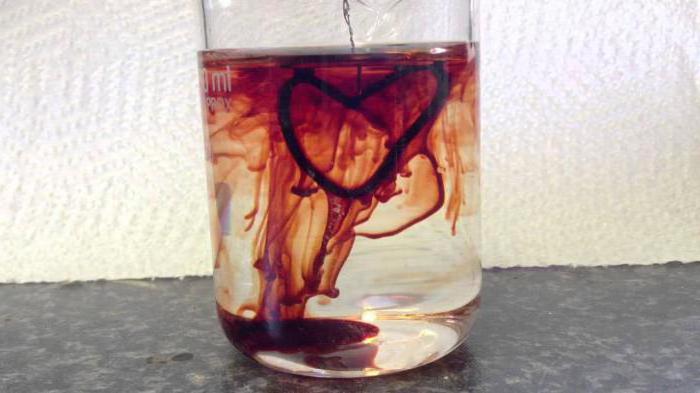
- In der analytischen Chemie, wird Kaliumthiocyanat-Lösung für die Bestimmung von Kationen des dreiwertigen Eisens in dem Material verwendet. Ein anschauliches Beispiel ist die Reaktion, die Kaliumthiocyanat und Eisen-III-Chlorid-3, auch als „Blut von Wasser“, bei dem ein purpurroten Kaliumhexacyanoferrat 3 genannt beinhaltet; common name – rotes Blutsalz. Thiocyanate auch für die Trennung von seltenen Metallen wie Thorium und Lanthan verwendet. Thiocyanat, Kaliumchlorid und Gelee hilft in letzter Zeit bei der Herstellung von künstlichem Blut für kinosomok, aber diese Methode geht auf der Strecke durch die Einführung in der Filmproduktion von Computergrafik.
- In der Landwirtschaft von Lösungen Thiocyanate starke Insektizide erhalten. Es gibt zwei mögliche Reaktionen:
- Zuerst – Aufnahme von Gas durch Thiocyano Kaliumsalz löschen; Rodan ist ein sehr gefährliches Gas für alle lebenden Organismen und wird selten verwendet.
- Zweitens – Lösen von Kaliumthiocyanat, Ladung während der Hydrolyse tsianovodorodnoy Säure und Oxidation der resultierenden Substanz zu Dicyan freigesetzt. Cyan – nicht weniger giftig, aber mehr schweres Gas im Vergleich zu Rodan und daher häufig als Insektizid verwendet.
Kaliumthiocyanat ist eine toxische Substanz, die letale Dosis etwa 0,9 Gramm Substanz pro Kilogramm Körpergewicht bei oraler Herstellung der Verbindung.
Verfügbarkeit
Kaliumthiocyanat kann wegen der relativ hohen Toxizität bei irgendwelchen Shop Chemikalien, aber in kleinen Mengen gekauft werden. Der Durchschnittspreis eines Reagens – vier Rubel pro Kilogramm, den Verkauf bis zwei Pfund pro Person meist begrenzt.
Sicherheit
Aufgrund seiner Toxizität, Kaliumthiocyanat muss gemäß den Sicherheitsbestimmungen in besonderen Bedingungen gelagert werden, für den Umgang mit toxischen Substanzen:
- Kristalle und Lösungen von Kaliumthiocyanat streng verboten eingenommen und in höchstem Maße unerwünscht Eindringen von Lösungen mit einer hohen Konzentration der basischen Substanz auf die Haut.
- Trotz der Tatsache, dass das Medikament nur toxisch ist, wenn die Anwendung Innere Arbeit, die mit dem Stoff wünschenswert ist, in Gummi-Handschuhe Labormantel, und wie bei allen Chemikalien zu den grundlegenden Sicherheitsanforderungen.
- Es ist notwendig, um das Material von Kindern und Personen zu isolieren, die als es unangenehme Vorfälle mit dem Verlust von Reagenzien verursacht keine Kenntnis von dem Techniker haben kann, Missbrauch und plötzlichen Tod.
- Da nicht brennbare Substanz und ausreichend stabil in der Luft ist es möglich, die Speichersubstanz im Dunkel zu verwalten. Trockenschrank. Vermeiden Sie hohe Luftfeuchtigkeit und direkte Sonneneinstrahlung, da aufgrund einer Verschlechterung der Reagenz Zersetzung seiner Bestandteile passieren kann. Auch Norm NFPA 704 orthorhombischen Kennzeichnung hat die folgenden Symbole: 3 0 0 W, wobei 3 (a blaue Pastille) – Toxizität, 0 (für rot und gelb) – Entflammbarkeit und Reaktivität, und W – Markierung für die Wechselwirkung mit Wasser, welche giftigen Thiocyansäure freigesetzt.

Und denken Sie daran, chemische Experimente – es ist erstaunlich und einzigartig, aber nie vernachlässigen Sicherheitsvorkehrungen!