Molekül: ein Molekulargewicht. Die Größe und die Masse der Moleküle
Die Zusammensetzung von komplexen Materialien, obwohl sie durch winzige Teilchen gebildet werden – Atome, Moleküle, Ionen. Die molekulare Struktur hat viele Flüssigkeiten und Gase, sowie einige Festkörper. Atome und Ionen umfassen Metalle, viele Salze. Alle Teilchen Masse, auch das kleinste Molekül. Masse des Moleküls, wenn wir es in Kilos auszudrücken, erhält einen sehr kleinen Wert. Zum Beispiel, m (H 2 O) = 30 • 10 -27 kg. Solche wichtigen Eigenschaften einer Substanz als das Gewicht und die Abmessungen der Mikropartikel, studierte Physiker und Chemiker seit langem. Die Fundamente wurden in den Arbeiten von Michail Lomonossow und legt Dzhona Daltona. Überlegen Sie, wie seit Blick auf den Mikrokosmos verändert.
Universität Präsentation von „Körperchen“
Die Annahme der diskreten Struktur der Materie von den Gelehrten des antiken Griechenland zum Ausdruck gebracht. Dann wurde ihm den Name „Atom“ die kleinsten unteilbaren Teilchen des Körpers, „Bausteine“ des Universums gegeben. Der große russische Gelehrte M. V. Lomonosov schrieb über die vernachlässigbare und unteilbar physikalischen bedeutet Partikelstruktur der Materie – Körperchen. Später, in den Schriften anderer Wissenschaftler, wurde sie „Molekül“ genannt.
Massen Molekül und seine Abmessungen werden durch die Eigenschaften seiner konstituierenden Atome bestimmt. Für eine lange Zeit haben Wissenschaftler in den Mikrokosmos nicht tiefer in der Lage zu sehen, die die Entwicklung der Chemie und Physik behindert. Lomonosov wiederholt aufgefordert, Kollegen auf genaue quantitative Daten zu lernen und in ihre Arbeiten – „Maß und Gewicht“ ein Durch die Arbeit der russischen Chemiker und Physiker , die Grundlagen der Lehre von der Struktur der Materie gelegt, die ein integraler Bestandteil einer kohärenten Atommolekulartheorie worden sind.

Atome und Moleküle – „Bausteine des Universums“
Selbst mikroskopisch kleine Objekte schwer zu finden, haben sie unterschiedliche Eigenschaften. Teilchen wie Atome, die von dem Kern und elektronischen Schichten gebildet unterscheiden sich in der Anzahl der positiven und negativen Ladungen Gewichts Radius. Atome und Moleküle in der Zusammensetzung von Substanzen existieren, nicht isoliert, werden sie auf unterschiedliche Kraft angezogen. Weitere spürbare Wirkung der Anziehungskräfte in Feststoffen, schwächer – in Flüssigkeiten, kaum in den gasförmigen Substanzen zu spüren.
Chemische Reaktionen sind nicht durch Zerstörung Atom begleitet. Meistens gibt es eine Umgruppierung von ihnen ist, ist es ein anderes Molekül. Massen Molekül hängt davon ab, was Atome es gebildet wird. Aber mit all den Veränderungen in den Atomen sind chemisch unteilbar. Aber sie können Teil verschiedenen Moleküle werden. Die Atome behalten die Eigenschaften des Elements, an das der. Molekül vor abklingende in Atom behält alle Eigenschaften der Substanz.
Mikroteilchen Struktur der Organe – das Molekül. Masse des Moleküls
Um die Masse macrobodies Geräte zu messen verwendet werden, von denen die ältesten – Skalen. Das Messer wird bequem in Kilogramm, als Grundeinheit der physikalischen Größen des internationalen Systems (SI) hergestellt. Um die molekulare Masse in Kilogramm zu bestimmen, ist es notwendig, ihre Atomgewichte festgelegt werden auf der Grundlage der Anzahl der Partikel. Der Einfachheit halber wurde eine spezielle Einheit der Masse eingeführt worden – Kern. Sie können sie in Form von Buchstaben-Abkürzungen (amu) schreiben. Diese Einheit entspricht einem Zwölftel der Masse des Nuklids von Kohlenstoff 12 C.
Wenn wir den Wert gefunden in Standardeinheiten ausdrücken, erhalten wir 1,66 • 10 -27 kg. Solche kleinen Indikatoren für die Massenkörper arbeiten hauptsächlich Physik. Der Artikel ist eine Tabelle, aus denen Sie lernen, was die Massen der Atome bestimmter chemischer Elemente sind. Um herauszufinden, was die Masse eines Moleküls Wasserstoff in Kilogramm ist, vermehren sich durch zwei in der Tabelle, die die Atommasse des chemischen Elements gezeigt. Das Ergebnis ist ein Gewichtswert, Moleküle, die aus zwei Atomen.
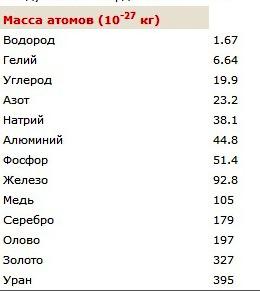
Relative Molekülmasse
Es ist schwierig, bei der Berechnung der sehr geringen Mengen zu arbeiten, ist es unbequem, führt zu zeitraubend, fehleranfällig. Wie für das Gewicht des Mikropartikels, dann war die Freigabe der schwierigen Situation ist die Verwendung von relativen Werten. Chemiker geläufiger Begriff besteht aus zwei Worten – „atomic mass“, sein Symbol – Ar. Identische Konzept wurde mit dem Molekulargewicht (die gleiche wie die Masse des Moleküls) eingeführt. Die Formel zur Regelung der beiden Größen: Mr = m (a target) / 1/12 m (12 C).
Oft kann man hören, was sie sagen „Molekulargewicht.“ Dieser veraltete Begriff auch in Bezug auf das Molekulargewicht, aber weniger häufig verwendet. Die Tatsache , dass das Gewicht – es ist eine andere physikalische Größe – deren Leistung hängt von den geographischen Koordinaten des Körpers. Im Gegensatz dazu ist die Masse eine konstante Eigenschaft des Partikels, die in chemischen Prozessen teilnehmen, und werden mit normaler Geschwindigkeit bewegen.

Wie das Molekulargewicht bestimmen
Die genaue Bestimmung des Molekulargewichts wird durch das Instrument durch – Massenspektrometers. Um die Probleme zu lösen, können Sie Informationen vom Periodensystem verwenden. Zum Beispiel ist die Masse eines Sauerstoffmoleküls 2 • 16 = 32. Wir einfache Berechnungen durchzuführen , und den Wert von Mr (H 2 O) finden – relatives Molekulargewicht von Wasser. Durch Periodensystem ist definiert , dass die Masse von Sauerstoff – 16, die Wasserstoff – 1. Zeichnen einfache Berechnungen: M r (H 2 O) = 1 + 2 • 16 = 18 ist , wobei M r – Molekulargewicht, H 2 O – Wassermolekül, H – Wasserstoff Symbolelement O – chemische Sauerstoffzeichen.
Massen der Isotope
Chemische Elemente in der Natur und Technik existieren, wie mehrere Arten von Atomen – Isotope. Jeder von ihnen hat ein Einzelgewicht, sein Wert kann nicht ein Bruchwert handeln. Allerdings ist das Atomgewicht des chemischen Elements oft eine Zahl mit mehreren Zeichen nach dem Punkt. Wenn die Berechnungen berücksichtigen die Prävalenz der einzelnen Arten in der Erdkruste. Daher sind die Masse der Atome im Periodensystem nicht notwendigerweise ganze Zahlen. Unter Verwendung dieser Werte für die Berechnungen, erhalten wir die Masse der Moleküle, die auch nicht ganze Zahlen. In einigen Fällen kann es ein Rundungswert sein.
Das Molekulargewicht der nicht-molekulare Struktur der Materie
Die meisten anorganischen Verbindungen sind nicht molecular structure. Metalle bestehen aus Atomen, Ionen und freien Elektronen, Salze – von Kationen und Anionen. Für Stoffe, nichtmolekulare Strukturen gezählt auch bedingte Moleküle der Bruttoformel, die einfachste Struktur widerspiegelt. Wir finden Mr Wert für ionische Substanzen Struktur – Salz, deren Formel NaCl. M r = 23 + 35,5 = 55,5. Für einige Arten von Berechnungen Molekülmasse von Luft erforderlich – Gasgemisch. Betrachtet man den prozentualen Anteil der verschiedenen Substanzen in der Atmosphäre, die molekulare Masse der Luft beträgt 29.
Die Größe und die Masse der Moleküle
Elektronenmikroskopische Aufnahmen von großen Molekülen können die einzelnen Atome betrachten, aber sie sind so klein, dass ein gewöhnliches Mikroskop nicht gesehen werden kann. Linearer Teilchengröße von irgendeiner Substanz als das Gewicht, – eine konstante Kennlinie. Der Durchmesser des Moleküls hängt von den Radien seiner konstituierenden Atome, ihre gegenseitige Anziehung. Die Partikelgrößen variieren mit der Anzahl der Protonen und Energieniveaus. Wasserstoffatom – die kleinste Größe, dessen Radius nur 0,5 • 10 -8 cm Uranatom ist dreimal mehr Wasserstoffatome .. Diese „Riesen“ des Mikrokosmos – die Moleküle der organischen Substanzen. Somit ist eine der linearen Abmessung des Proteinpartikels 44 • 10 -8 cm.
Um es zusammenzufassen: die Masse der Moleküle – ist die Summe der Massen der Atome in ihnen. Der absolute Wert in Kilogramm kann durch Multiplikation des Molekulargewichtes des Periodensystems, wobei die Menge 1,66 • 10 -27 kg gefunden , erhalten werden.
Die Moleküle sind vernachlässigbar im Vergleich zu dem Makro-Körper. Zum Beispiel in der Größe von Wassermolekül H 2 O gibt den Apfel so oft, wie oft diese Frucht kleiner ist als unser Planet ist.