Die allgemeine Formel für Alkene. Eigenschaften und Charakterisierung von Alkene
Die einfachsten organischen Verbindungen umfassen gesättigte und ungesättigte Kohlenwasserstoffe. Dazu gehören Stoffe der Klasse Alkane, Alkine, Alkene. 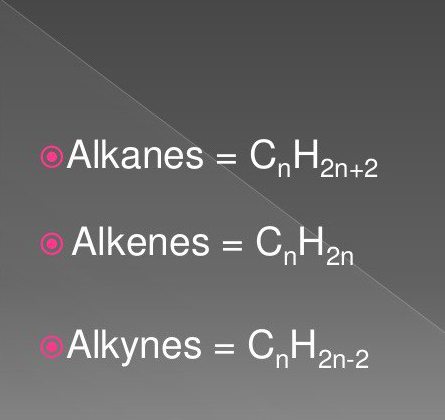
Die Formel hierfür schließen Wasserstoff und Kohlenstoffatomen in einer bestimmten Reihenfolge und Menge. Sie sind oft in der Natur zu finden.
Bestimmung der Alkene
Andere ihren Namen – oder Kohlenwasserstoffe Olefine Ethylen. Es wird so die Klasse aktiver Verbindungen im 18. Jahrhundert, als ölige Flüssigkeit genannt öffnen – Ethylenchlorid.
Durch Alkene sind Substanzen aus Kohlenstoff und Wasserstoffelementen zusammengesetzt. Sie gehören zu den acyclischen Kohlenwasserstoffe. Diese Moleküle sind derzeit nur Doppel (ungesättigte) Bindung, die die beiden Kohlenstoffatome miteinander.
Formel Alkene
Jede Klasse von Verbindungen hat eine chemische Bezeichnung. Die Symbole sind die Elemente des Periodensystems, die Zusammensetzung und die Struktur der Verbindung jeder Substanz angegeben. 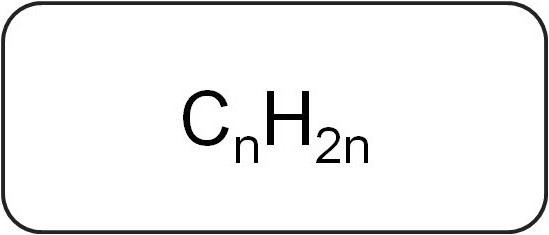
Die allgemeine Formel von Alkenen wie folgt bezeichnet: C n H 2n, wobei die Zahl n größer als oder gleich 2. Wenn es zu entziffern , dass jedes Kohlenstoffatom an zwei Wasserstoffatom hat gesehen werden kann.
Summenformel Alkene der homologen Reihe , dargestellt durch die folgenden Strukturen: C 2 H 4, C 3 H 6, C 4 H 8, C 5 H 10, C 6 H 12, C 7 H 14, C 8 H 16, H 18 C 9, C 10 H 20. Es ist ersichtlich, daß jeder aufeinanderfolgende Kohlenwasserstoff ein C an der 2 und mehr Wasserstoff enthält.
Es ist ein grafisches Symbol Lage und die Reihenfolge von chemischen Verbindungen zwischen den Atomen in dem Molekül, welches die Strukturformel von Alkenen zeigt. Mit Hilfe der Wertigkeit von Kohlenstoff und Wasserstoff angegeben.
Alkene Strukturformel kann in der erweiterten Form dargestellt werden, wenn gezeigt wird, alle chemischen Elemente und Verbindungen. Ein prägnanter Ausdruck keine Olefine Kohlenstoffverbindung und Wasserstoff mittels Valenz gezeigt.
Formel Skelett Die einfachste Struktur bezeichnen. Die gestrichelte Linie stellt die Grundlage des Moleküls in dem Kohlenstoffatom mit ihren Oberseiten und Enden präsentiert werden, und Wasserstoff Punkt-Verbindungen.
Wie der Name von Olefinen zu bilden
Basierend auf der systematischen Nomenklatur, Formel und Namen von Alkenen aus Alkanen dar, die Struktur zu gesättigten Kohlenwasserstoffen betreffen. Um dies zu tun, im Namen des letzten Suffix -an durch -ilen oder -en ersetzt. Ein Beispiel ist die Bildung von Butan-Butylen und Penten aus Pentan.
Um anzuzeigen, die Position relativ zu dem Doppelanschluss von Kohlenstoffatomen in arabischen Ziffern in dem Ende des Namens gekennzeichnet.
Im Herzen des Namen von Alkenen ist die Bezeichnung des Kohlenwasserstoffen mit der längsten Kette, in der die Doppelbindung vorliegt. Während des Startens Numerierung der Kette wird typischerweise ausgewählt Ende, das am nächsten an der ungesättigten Verbindung ist, Kohlenstoffatome.
Wenn die Strukturformel von Alkenen hat Zweige, die Radikalen Namen und die Nummer angeben, und diesen Stellen entsprechende Stelle in der Kohlenstoffkette zu ergeben. durch den Namen des Kohlenwasserstoffen gefolgt. Nachdem die Zahlen sind in der Regel einen Bindestrich setzen.
Es ungesättigter Rest Ableger. Ihre Namen können nach den Regeln der systematischen Nomenklatur trivial oder gebildet sein.
Zum Beispiel NSC = CH- bezeichnet Ethenyl oder Vinyl.
Isomere
Molekulare Formel Alkene zeigt möglicherweise nicht die Isomerie. Jedoch ist für diese Klasse von Substanzen, mit Ausnahme des Ethylen inhärente räumliche Variation Molekül. 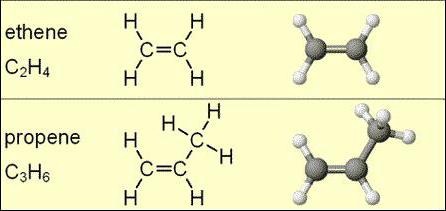
Isomere ethylenische Kohlenwasserstoffe kann am Kohlenstoffgerüst sein, an ungesättigten Kommunikations Position oder räumliche Interklassen.
Die allgemeine Formel von Alkenen bestimmt die Menge an Kohlenstoff und Wasserstoffatomen in der Kette, zeigt aber nicht das Vorhandensein und die Position einer Doppelbindung darin. Ein Beispiel ist der Cyclopropan als Quer Klasse Isomeres C 3 H 6 (Propylen). Andere Arten von Isomerie sind an C 4 H 8 oder Buten gezeigt.
Verschiedenes ungesättigte Kommunikationsstatus tritt in dem Buten-1 oder Buten-2, im ersten Fall wird eine doppelte Verbindung ist in der Nähe des ersten Kohlenstoffatom ist, und in der zweiten – in der Mitte der Kette. Isomere von Kohlenstoffgerüst kann beispielsweise methylpropen (CH 3 -C (CH 3) = CH 2) und Isobutylen ((CH3) 2C = CH 2) betrachtet werden.
Räumliche Variation inhärente Buten-2 und cis-trans-Stellung. Im ersten Fall sind Seitengruppen oberhalb und unterhalb der Hauptkohlenstoffkette mit einer Doppelbindung in den zweiten Isomers Substituenten auf der gleichen Seite befinden.
Eigenschaften von Olefinen
Die allgemeine Formel für Alkene bestimmt den physischen Zustand aller Mitglieder dieser Klasse. Beginnend und endend mit Ethylen Butylen (C 2 bis C 4), existieren Substanzen in einer gasförmigen Form. So farblos Ethen hat Süßlich Geruch, eine geringe Löslichkeit in Wasser, Molekulargewicht kleiner als die von Luft.
In flüssiger Form präsentierte Kohlenwasserstoffe homologen Zeitraum von C 5 bis C 17. Beginnend mit dem Alken in der Hauptkette von 18 Kohlenstoffatomen, ein Übergang des Aggregatzustandes in einer festen Form.
Alle Olefine Rang schlechte Löslichkeit in wässrigen Medien, aber gut in der organischen Natur des Lösungsmittels, wie Benzol oder Benzin. Ihr Molekulargewicht ist geringer als die von Wasser. Eine Erhöhung der Kohlenstoffkette führt zu einer Zunahme der Temperatureigenschaften durch Schmelz- und Siedepunkte dieser Verbindungen.
Eigenschaften Olefine
Strukturformel Alkene zeigt die Anwesenheit von Doppelbindungen im Skelett und σ- von pgr Verbinden von zwei Kohlenstoffatomen. Diese Struktur des Moleküls bestimmt seine chemischen Eigenschaften. Communication-π gilt als nicht sehr stark sein, was es möglich macht, es zu zerstören mit der Bildung von zwei neuen Anleihen-σ, die als Ergebnis erhalten werden, ein Paar von Atomen verbinden. Die ungesättigten Kohlenwasserstoffe sind Elektronendonoren. Sie nehmen an den Prozessen der elektro Typ-Verbindung. 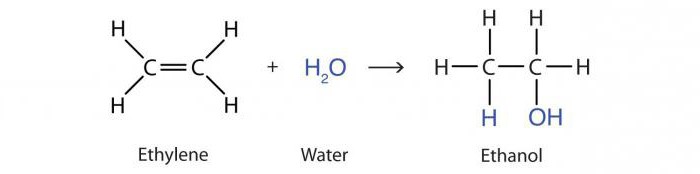
Eine wichtige chemische Eigenschaft von Alkenen ist ein Halogenierungsverfahren mit der Freisetzung von Verbindungen, wie digalogenoproizvodnym Substanzen. Halogenatome können an die Verbindung, die durch doppelte Kohlenstoffatomen gebunden sein. Ein Beispiel ist die Bromierung von Propylen-1,2-Dibrompropan zu bilden:
H 2 C = CH-CH 3 + Br 2 → BrCH 2 -CHBr-CH 3.
Diese Neutralisationsverfahren Farben in Bromwassers Alkene als qualitative Beweise für das Vorhandensein von Doppelbindung.
Wichtige Reaktionen olifinov Hydrierung unter Zugabe von Wasserstoffmolekülen unter Einwirkung von Katalysatormetallen, wie Platin, Palladium oder Nickel bezieht. Dies führt zu Kohlenwasserstoffen mit einer gesättigten Bindung. Formel Alkane, Alkene sind unten in der Hydrierung von Buten gegeben:
CH 3 -CH 2 -CH = CH 2 + H 2 → CH 3 Ni -CH 2 -CH 2 -CH 3.
Der Vorgang des Verbindens Halogenids Moleküle genannt Olefine
gidrogalogenirovaniem von der Regel vorbei, offen Markownikow-. Ein Beispiel ist die Hydrobromierung von Propylen 2-Brompropan zu bilden. Es ist mit der Wasserstoff-Kohlenstoff-Doppelbindung verbunden ist, das das hydrierte betrachtet wird:
CH 3 -CH = CH 2 + HBr → CH 3 -BrCH-CH 3.
Alkene Wasser Additionsreaktion mit Säuren wird als Hydratation bekannt. Das Ergebnis ist ein Molekül , von dem Alkohol 2-Propanol :
CH 3 -HC = CH 2 + H 2 O → CH 3 -OHCH-CH 3 ist .
Bei Einwirkung von Alkenen auftritt Schwefelsäure Sulfonierungsverfahren:
CH 3 -HC = CH 2 + HO-OSO-OH → CH 3 CH 3 CH-OSO 2 -OH.
Die Reaktion verläuft mit der Bildung von Säureester, z.B. izopropilsernoy Säure.
Alkene oxidationsanfällig während ihrer Verbrennung unter der Einwirkung von Sauerstoff zu Wasser und Kohlendioxid zu bilden:
2CH 3 -HC = CH 2 + 2 → 9O 6CO 2 + 6H 2 O.
Die Umsetzung von olefinischen Verbindungen und eine verdünnte Kaliumpermanganat in Lösung führt zu einer Struktur, Glykole oder zweiwertige Alkohol. Diese Reaktion wird auch Oxidieren Ethylenglycol und Bleichlösung zu bilden:
3H 2 C = CH 2 + 4H 2 O + 2KMnO 4 → 3OHCH-CHOH + 2MnO 2 + 2 KOH.
Alkenmolekül kann in der Polymerisation mit einem radikalischen oder kationischen-anionischen Mechanismus beteiligt sein. Im ersten Fall wird unter dem Einfluss von Peroxiden Polyethylen-Typ Polymer erhalten.
Gemäß dem zweiten Mechanismus kationischen Katalysatoren sind die Säuren und anionische Mittel sind organometallische Polymer mit Zuordnung stereoselektiv.
Was Alkanen
Sie sind Paraffine genannt oder acyclische Kohlenwasserstoffe begrenzen. Sie haben eine lineare oder verzweigte Struktur, die gesättigt nur Einfachbindungen enthält. Alle Mitglieder der homologen Reihe dieser Klasse haben die allgemeine Formel C n H 2n + 2. 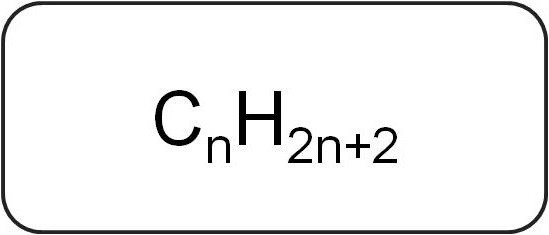
In ihrer Struktur enthält nur Kohlenstoff und Wasserstoffatom. Die allgemeine Formel des Alkens gebildet Notation gesättigten Kohlenwasserstoffen.
Die Namen von Alkanen und deren Eigenschaften
Der einfachste Vertreter dieser Klasse ist Methan. Gefolgt von Substanzen wie Ethan, Propan und Butan. Die Grundlage ihres Namens ist die Wurzel der Zahl in der griechischen Sprache, zu dem das Suffix -an hinzugefügt. Alkane Namen werden in der IUPAC-Nomenklatur aufgeführt.
Die allgemeine Formel für Alkene, Alkine, Alkane enthält nur zwei Arten von Atomen. Dazu gehören die Elemente Kohlenstoff und Wasserstoff. Die Zahl der Kohlenstoffatome in allen drei Klassen Spiele, Kontrast ist nur in der Anzahl von Wasserstoff beobachtet, die gespalten oder beitreten werden kann. Aus gesättigten Kohlenwasserstoffen mit ungesättigten Verbindungen erhalten. Die Vertreter der Paraffine in dem Molekül enthalten ist, 2 Wasserstoffatom mehr als das Olefin, das eine allgemeine Formel von Alkanen, Alkenen bestätigt. Alkene Struktur wird aufgrund der Anwesenheit der ungesättigten Doppelbindung in Betracht gezogen.
Wenn wir die Anzahl der Wasserstoff- und Kohlenstoffatomen im Alkan, der Maximalwert wird im Vergleich mit anderen Klassen von Kohlenwasserstoffen zu vergleichen.
Da Methan und endend Butan (C 1 bis C 4), existieren Substanzen in einer gasförmigen Form.
In flüssiger Form präsentierte Kohlenwasserstoffe homologen Zeitraum von C 5 bis C 16. Da Alkan in der Hauptkette von 17 Kohlenstoffatomen, ein Übergang des Aggregatzustandes in einer festen Form.
Sie werden durch Isomerie des Kohlenstoffgerüsts und optische Änderungen des Moleküls gekennzeichnet. 
Die Paraffine Kohlen Valenzen sind vollständig belegt benachbarten Kohlenstoffatomen oder Wasserstoff als eine Verbindung σ-Typ zu bilden. Aus chemischer Sicht führt dies zu ihren schwächeren Eigenschaften, weshalb Alkane genannt Grenze oder gesättigte Kohlenwasserstoffe fehlen Affinität.
Sie treten in Substitutionsreaktionen im Zusammenhang mit der Halogenierung mit einer Rest Typ Nitrierung Sulfochlorierung oder Moleküle.
Paraffinen läuft einen Prozess der Oxidation, Verbrennung oder Zersetzung bei hohen Temperaturen. Unter der Wirkung Beschleunigern auftreten Spaltungsreaktionen ein Wasserstoffatom oder Dehydrierung von Alkanen.
Was ist Alkinen
Sie werden auch Acetylen Kohlenwasserstoffe genannt wird, in denen der Kohlenstoff in der Kette Dreifachbindung vorhanden ist. Die Struktur des Alkin durch die allgemeine Formel C n H 2 beschriebenen n-2. Man erkennt, dass von acetylenischer Kohlenwasserstoffe im Unterschied zu Alkanen zu sehen, vier Wasserstoffatome fehlen. Sie ersetzen die Dreifachbindung, gebildet durch zwei π- Verbindungen.
Diese Struktur bestimmt die chemischen Eigenschaften dieser Klasse. Die Strukturformel von Alkenen und Alkinen zeigt Ungesättigtheit der Moleküle und das Vorhandensein von Doppel (H 2 C꞊CH 2) und Tripel (HC≡CH) -Verbindung.
Name Alkine und ihre Eigenschaften
Der einfachste Vertreter ist Acetylen oder HC≡CH. Es wird auch als Ethinyl bezeichnet. Es ergibt sich aus dem Namen des gesättigten Kohlenwasserstoff, der das Suffix -an entfernt und fügen -in. In dem Namen des Lang Alkin Figur zeigt die Position der Dreifachbindung.
Die Kenntnis der Struktur des Kohlenwasserstoff gesättigt und ungesättigt, kann sie zeigt für Alkine der allgemeinen Formel unter einem Buchstaben bestimmt werden: a) C n H 2n; a) C n H 2n + 2; c) CnH2n-2; g) CnH2n-6. Die richtige Antwort ist die dritte Option.
Ausgehend von Acetylen und endend Butan (C 2 bis C 4), sind Substanzen , die in der Natur gasförmige. 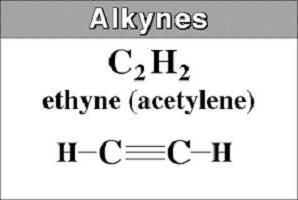
In flüssiger Form Kohlenwasserstoffe ist homolog Zeitraum von C 5 bis C 17. Beginnend mit Alkin in der Hauptkette von 18 Kohlenstoffatomen, ein Übergang des Aggregatzustandes in einer festen Form.
Sie werden durch Isomerie des Kohlenstoffgerüsts, auf dem Status der Kommunikation und Interklassen triple modifizierenden Molekül gekennzeichnet.
Durch chemische Eigenschaften ähnlich acetylenischen Kohlenwasserstoffen Alkenen.
Wenn die terminalen Alkin-Dreifachbindung, arbeiten sie eine Säurefunktion alkinidov Salze zu bilden, beispielsweise NaC≡CNa. Die Anwesenheit der beiden π-Bindungen macht das Molekül ein starkes Nucleophil Natrium atsetiledina Reaktionen in Substitution eintritt.
Acetylen wird in Gegenwart von Kupferchlorid chloriert Dichloracetyl, Kondensation unter Einwirkung eines Freisetzungs Halogenalkinyl diacetylenischen Moleküle zu erhalten.
Alkine in elektroAdditionsReaktionen teilnehmen, das Prinzip, das die Halogenierung gidrogalogenirovaniya, Hydrierung und Carbonylierung zugrunde liegt. Allerdings sind solche Prozesse schwächer als die von Alkene mit einer Doppelbindung.
Für acetylenischen Kohlenwasserstoffe können Additionsreaktion des Alkohols Typ-Molekül, einem primären Amin oder Sulfid nukleophilen.


















