Internationale Nomenklatur von Alkanen. Alkane: Struktur, Eigenschaften
Es wird sinnvoll sein, mit der Definition des Begriffs der Alkane zu beginnen. Dies sind gesättigte oder gesättigte Kohlenwasserstoffe, Paraffine. Es kann auch gesagt werden, dass es sich um Kohlenstoffe handelt, in denen die Kombination von C-Atomen durch einfache Bindungen durchgeführt wird. Die allgemeine Formel hat die Form: CnH & sub2; n + 2.
Es ist bekannt, dass das Verhältnis der Anzahl der H- und C-Atome in ihren Molekülen im Vergleich zu anderen Klassen maximiert wird. Angesichts der Tatsache, daß alle Valenzen entweder durch C oder H besetzt sind, sind die chemischen Eigenschaften der Alkane nicht klar ausgedrückt, daher ist der zweite Term der Begriff gesättigte oder gesättigte Kohlenwasserstoffe.
Es gibt auch einen älteren Namen, der am besten reflektiert ihre relative Chemie – Paraffine, die in der Übersetzung bedeutet "ohne Affinität".
So ist das Thema unserer heutigen Konversation: "Alkans: Homologie-Reihe, Nomenklatur, Struktur, Isomerie". Daten über ihre physikalischen Eigenschaften werden ebenfalls präsentiert.
Alkans: Gebäude, Nomenklatur
In ihnen befinden sich die C-Atome in einem solchen Zustand wie die sp3-Hybridisierung. Im Zusammenhang damit kann das Alkanmolekül als ein Satz von tetraedrischen C-Strukturen nachgewiesen werden, die nicht nur aufeinander bezogen sind, sondern auch auf H. 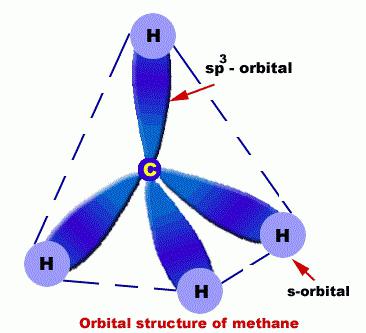
Zwischen den Atomen C und H gibt es starke, sehr niedrige Polaritäts-s-Bindungen. Atome um einfache Bindungen drehen sich immer, so dass die Moleküle der Alkane eine Vielzahl von Formen nehmen, mit der Länge der Verbindung, der Winkel zwischen ihnen – konstante Werte. Formen, die aufgrund der um die σ-Bindungen auftretenden Rotation des Moleküls ineinander verwandelt werden, ist es üblich, sie als Konformationen zu bezeichnen. 
Während der Ablösung des H-Atoms aus dem fraglichen Molekül entstehen 1-wertige Partikel, sogenannte Kohlenwasserstoffreste,. Sie erscheinen als Folge von Verbindungen von nicht nur organischen Substanzen, sondern auch anorganischen Verbindungen. Wenn wir 2 Wasserstoffatome aus dem Molekül des limitierenden Kohlenwasserstoffs nehmen, erhalten wir 2-wertige Reste.
So kann die Nomenklatur von Alkanen sein:
- Radial (alte Version);
- Ersatz (international, systematisch). Es wird von IUPAC vorgeschlagen.
Merkmale der radialen Nomenklatur
Im ersten Fall ist die Nomenklatur der Alkane durch folgendes gekennzeichnet:
- Berücksichtigung von Kohlenwasserstoffen als Derivate von Methan, bei denen ein oder mehrere H-Atome mit Resten substituiert sind.
- Hohe Bequemlichkeit bei nicht sehr komplexen Verbindungen.
Merkmale der Ersatznomenklatur
Die Alkan-Nomenklatur hat folgende Merkmale:
- Die Grundlage für den Namen ist 1 Kohlenstoffkette, während die restlichen molekularen Fragmente als Substituenten betrachtet werden.
- In Gegenwart von mehreren identischen Radikalen, vor ihrem Namen ist die Zahl (streng in Worten) angegeben, und die radikalen Zahlen sind durch Kommas getrennt.
Chemie: Nomenklatur von Alkanen
Aus Gründen der Bequemlichkeit werden die Informationen in Form einer Tabelle dargestellt.
|
Name des Stoffes |
Die Basis des Namens (Wurzel) |
Molekulare Formel |
Der Name des Kohlenstoff-Substituenten |
Die Kohlenstoff-Substituenten-Formel |
|
Methan |
Met- |
CH & sub4; |
Methyl |
CH & sub3; |
|
Ethan |
Et- |
C & sub2; H & sub5; |
Ethyl |
C & sub2; H & sub5; |
|
Propan |
Prop- |
Sub3; |
Hat getrunken |
Sub3; |
|
Bhutan |
Aber – |
C & sub4; H & sub1; |
Butyl |
C & sub4; H & sub5; |
|
Pentan |
Pent- |
C₅H & sub1; & sub2; |
Pentyl |
C₅H & sub1; & sub1; |
|
Hexan |
Hex- |
C₆H & sub1; & sub4; |
Hexil |
C₆H & sub1; & sub3; |
|
Heptan |
Hept- |
C₇H & sub1; & sub0; |
Heptyl |
C₇H & sub1; & sub0; |
|
Oktan |
Octo- |
C₈H & sub1; & sub0; |
Octyl |
C₈H & sub1; & sub0; |
|
Nonan |
Nicht- |
C₉H₂₀ |
Nonil |
C₉H & sub1; & sub0; |
|
Dekan |
Dec- |
C & sub1; & sub9; H & sub2; |
Decil |
Sub2; & sub1; |
Die obige Nomenklatur von Alkanen schließt Namen ein, die sich historisch entwickelt haben (die ersten 4 Mitglieder einer Reihe von terminalen Kohlenwasserstoffen).
Die Namen der nicht entfalteten Alkane mit 5 oder mehr C-Atomen werden aus griechischen Ziffern gebildet, die die gegebene Anzahl von C-Atomen widerspiegeln, so dass die Suffix -an anzeigt, dass die Substanz aus einer Anzahl gesättigter Verbindungen stammt. 
Wenn die Namen der eingesetzten Alkane aufgestellt werden, wird die Hauptkette so gewählt, daß sie die maximale Anzahl an C-Atomen enthält. Es ist so nummeriert, daß die Substituenten die niedrigste Zahl haben. Im Falle von zwei oder mehr Ketten der gleichen Länge ist die wichtigste diejenige, die die größte Anzahl von Substituenten enthält.
Isomerie von Alkanen
Als Kohlenwasserstoff ist das Elternteil ihrer Reihe Methan CH & sub4 ;. Bei jedem aufeinanderfolgenden Vertreter der Methanreihe gibt es einen Unterschied zum vorherigen zu der Methylengruppe – CH . Diese Regelmäßigkeit kann im ganzen Bereich der Alkane verfolgt werden.
Der deutsche Wissenschaftler Schiel hat einen Vorschlag vorgelegt, um diese Serie homolog zu nennen . Im Griechischen bedeutet es "ähnlich, ähnlich".
Somit ist die homologe Reihe ein Satz von verwandten organischen Verbindungen mit der gleichen Struktur mit ähnlichen chemischen Eigenschaften. Homologe sind Mitglieder dieser Serie. Der homologische Unterschied ist eine Methylengruppe, auf die sich 2 benachbarte Homologe unterscheiden.
Wie bereits erwähnt, kann die Zusammensetzung eines beliebigen gesättigten Kohlenwasserstoffs durch die allgemeine Formel CnH & sub2; n + 2 ausgedrückt werden. Somit ist das nächste Mitglied der homologen Reihe Methan-C & sub2; H следующим. Um seine Struktur aus Methan abzuleiten, ist es notwendig, 1 Atom H mit CH & sub3; (Abbildung unten) zu ersetzen. 
Die Struktur jedes nachfolgenden Homologen kann aus dem vorherigen in gleicher Weise abgeleitet werden. Als Ergebnis erzeugt Ethan Propan-C & sub3; H & sub5 ;.
Was ist Isomere?
Hierbei handelt es sich um Stoffe, die eine identische qualitative und quantitative molekulare Zusammensetzung (identische molekulare Formel) aufweisen, aber unterschiedliche chemische Strukturen aufweisen und unterschiedliche chemische Eigenschaften besitzen.
Die obigen Kohlenwasserstoffe unterscheiden sich in einem solchen Parameter wie der Siedepunkt: -0,5 ° – Butan, -10 ° – Isobutan. Diese Art von Isomerie wird als Isomerie des kohlenstoffhaltigen Skeletts bezeichnet, sie bezieht sich auf den Strukturtyp.
Die Anzahl der strukturellen Isomeren wächst rasch mit einer Zunahme der Anzahl der Kohlenstoffatome. Somit entspricht C & sub1; & sub9; H & sub2; & sub2; zu 75 Isomeren (ohne räumliche) und für C & sub1; & submin; & sub3; & sub3; & sub2; & sub3; & sub3; & sub3; -Isomere sind bereits bekannt, für C & sub2; & sub9; H & sub4; & sub2; ist es 366 319.
So wurde klar, welche Alkane, homologe Serien, Isomerie, Nomenklatur. Jetzt ist es Zeit, auf die Regeln für die Kompilierung von Namen für IUPAC zu gehen. 
Nomenklatur IUPAC: Regeln für die Namensgebung
Zuerst ist es notwendig, die Kohlenstoffkette in der Kohlenwasserstoffstruktur zu finden, die am längsten ist und die maximale Anzahl an Substituenten enthält. Dann ist es erforderlich, die C-Atome der Kette zu nummerieren, beginnend am Ende, an dem der Substituent am nächsten liegt.
Zweitens ist die Basis der Name eines unverzweigten gesättigten Kohlenwasserstoffs, dem die wichtigste Kette der Anzahl der C-Atome entspricht.
Drittens ist es vor der Basis notwendig, die Anzahl der Schlösser anzugeben, in denen sich die Substituenten befinden. Sie folgen einem Bindestrich mit den Namen der Abgeordneten.
Viertens werden im Falle der Anwesenheit von identischen Substituenten für verschiedene C-Atome die Sperren kombiniert, wobei das Multiplikator-Präfix vor dem Namen erscheint: di – für zwei identische Substituenten, drei für drei, Tetra-Vier, Penta für fünf usw. Figuren Sollte durch ein Komma und aus Worten durch ein Bindestrich voneinander getrennt sein.
Wenn das gleiche C-Atom gleichzeitig zwei Substituenten enthält, wird lokal auch zweimal aufgezeichnet.
Nach diesen Regeln wird die internationale Nomenklatur der Alkane gebildet. 
Projektionen von Newman
Dieser amerikanische Wissenschaftler schlug spezielle Projektion Formeln – die Newman Projektionen – für grafische Demonstration von Konformationen. Sie entsprechen den Formen A und B und sind in der folgenden Abbildung dargestellt. 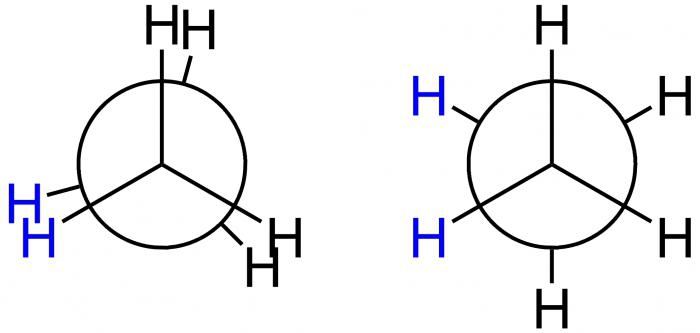
Im ersten Fall handelt es sich hierbei um eine A-Screening-Konformation, während im zweiten Fall B-inhibiert ist. In Position A befinden sich die H-Atome in einem minimalen Abstand voneinander. Diese Form entspricht dem größten Wert der Energie, weil die Abstoßung zwischen ihnen am größten ist. Dies ist ein energetisch ungünstiger Zustand, weshalb das Molekül dazu neigt, es zu verlassen und zu einer stabileren Position B zu gehen. Hier sind die H-Atome in einem maximalen Abstand zueinander. Somit beträgt die Energiedifferenz dieser Positionen 12 kJ / mol, wodurch die freie Drehung um die Achse im Ethanmolekül, die die Methylgruppen verbindet, ungleichmäßig erhalten wird. Nach dem Einfallen in eine energetisch günstige Position wird das Molekül dort verzögert, mit anderen Worten: "verlangsamt". Deshalb heißt es gehemmt. Das Ergebnis – 10 Tausend Ethan-Moleküle sind in einer gehinderten Form der Konformation unter der Bedingung der Raumtemperatur. Nur eine hat eine andere Form – eine abgeschirmte.
Erfassung von Limit Kohlenwasserstoffen
Aus dem Artikel wurde bereits bekannt, dass es sich um Alkane handelt (die Struktur, die Nomenklatur von ihnen wird im Detail früher beschrieben). Es wird sinnvoll sein, Wege zu finden, um sie zu erhalten. Sie werden aus solchen natürlichen Quellen wie Öl, Erdgas, assoziiertes Gas, Kohle zugeteilt. Synthetische Methoden werden auch verwendet. Beispiel: H & sub2; 2H & sub2;
- Das Verfahren der Hydrierung von ungesättigten Kohlenwasserstoffen: CnH & sub2; n (Alkene) → CnH & sub2; n + 2 (Alkane) ← CnH & sub2; n-2 (Alkine).
- Aus dem Gemisch aus Monoxid C und H – Synthesegas: nCO + (2n + 1) H₂ → CnH₂n + 2 + nH₂O.
- Von den Carbonsäuren (ihre Salze): Elektrolyse auf der Anode, auf der Kathode:
- Kolbe-Elektrolyse: 2RCOONa + 2H₂O → R-R + 2CO₂ + H₂ + 2NaOH;
- Dumas-Reaktion (Legierung mit Alkali): CH & sub3; COONa + NaOH (t) → CH & sub4; + Na & sub2; CO & lt; / s & gt;
- Ölrissbildung: CnH & sub2; n + 2 (450-700º) → CmH & sub2; m + 2 + Cn-mH & sub2; (nm).
- Vergasung von Brennstoff (fest): C + 2H₂ → CH .
- Synthese von komplexen Alkanen (halogenierte Derivate) mit weniger C-Atomen: 2CH₃Cl (Chlormethan) + 2Na → CH₃-CH₃ (Ethan) + 2NaCl.
- Zersetzung mit Wasser von Methaniden (Carbide von Metallen): Al & sub4; C & sub3; + 12H & sub2; O → 4Al (OH & sub3;) ↓ + 3CH & sub4; ↑.
Physikalische Eigenschaften von ultimativen Kohlenwasserstoffen
Aus Gründen der Bequemlichkeit werden die Daten in eine Tabelle gruppiert.
|
Formel |
Alcan |
Schmelzpunkt in ° C |
Siedepunkt in ° C |
Dichte, g / ml |
|
CH & sub4; |
Methan |
-183 |
-162 |
0,415 bei t = -165ºC |
|
C & sub2; H & sub5; |
Ethan |
-183 |
-88 |
0,561 bei t = -100ºC |
|
Sub3; |
Propan |
-188 |
-42 |
0,583 bei t = -45ºC |
|
N-C & sub4; H & sub1; & sub0; |
N-Butan |
-139 |
-0,5 |
0,579 bei t = 0ºC |
|
2-Methylpropan |
– 160 |
– 12 |
0,557 bei t = -25ºC |
|
|
2,2-Dimethylpropan |
– 16 |
9.5 |
0,613 |
|
|
N-C₅H & sub1; & sub2; |
N-Pentan |
-130 |
36 |
0,626 |
|
2-Methylbutan |
– 160 |
28 |
0,620 |
|
|
N-C₆H & sub1; & sub4; |
N-Hexan |
– 95 |
69 |
0,660 |
|
2-Methylpentan |
– 153 |
62 |
0.683 |
|
|
N-C₇H & sub1; & sub0; |
N-Heptan |
– 91 |
98 |
0,683 |
|
n-C₈H₁₈ |
n-Octan |
– 57 |
126 |
0,702 |
|
2,2,3,3-Tetra-Methyl |
– 100 |
106 |
0656 |
|
|
2,2,4-Pentan |
– 107 |
99 |
0,692 |
|
|
n-C₉H₂₀ |
n-Nonan |
– 53 |
151 |
0718 |
|
n-C₁₀H₂₂ |
n-Decan |
– 30 |
174 |
0,730 |
|
n-C₁₁H₂₄ |
n-Undecan |
– 26 |
196 |
0,740 |
|
n-C₁₂H₂₆ |
n-Dodecan |
– 10 |
216 |
0,748 |
|
n-C₁₃H₂₈ |
n-Tridecan |
– 5 |
235 |
0756 |
|
n-C₁₄H₃₀ |
n-Tetradecan |
6 |
254 |
0,762 |
|
n-C₁₅H₃₂ |
n-Pentadecan |
10 |
271 |
0,768 |
|
n-C₁₆H₃₄ |
n-Hexadecan |
18 |
287 |
0,776 |
|
n-C₂₀H₄₂ |
n-Eicosan |
37 |
343 |
0,788 |
|
n-C₃₀H₆₂ |
n-Triakontan |
66 |
235 mit 1 mm Hg. Artikel |
0,779 |
|
n-C₄₀H₈₂ |
n-Tetrakontan |
81 |
260 mit 3 mm Hg. Art. |
|
|
n-C₅₀H₁₀₂ |
n-Pentakontan |
92 |
bei 420 15 mm Hg. Art. |
|
|
n-C₆₀H₁₂₂ |
n-Geksakontan |
99 |
||
|
n-C₇₀H₁₄₂ |
n-Geptakontan |
105 |
||
|
n-C₁₀₀H₂₀₂ |
n-Gektan |
115 |
Abschluss
Der Artikel wurde so etwas wie Alkane betrachtet (Struktur, Nomenklatur, Isomerie, homologe Reihe und so weiter.). Es sagt uns etwas über die Merkmale von Radial- und Substitution Nomenklaturen. Es sind Verfahren zur Gewinnung von Alkanen beschrieben.
Außerdem enthalten sind die Artikel im Detail alle die Nomenklatur des Alkane (Test kann helfen, die Informationen zu assimilieren).

















