Summen- und Strukturformel Methan
Molekular-, strukturelle und elektronische Formel von Methan auf der Theorie der Struktur organischer Verbindungen Butlerov basieren. Bevor diese Formeln zu schreiben, beginnen wir mit einer kurzen Charakterisierung des Kohlenwasserstoffen.

Methan Eigenschaften
Diese Substanz ist ein explosive, es wird auch als „Sumpf“ Gas genannt. Der spezifische Geruch des limitierenden Kohlenwasserstoffe alle bekannt. Der Verbrennungsprozess wird Komponenten schädliche chemische links auf den menschlichen Körper. Das Methan ist ein aktiver Teilnehmer an der Bildung des Treibhauseffektes.
physikalische Eigenschaften
Der erste Vertreter der homologen Reihe von Alkanen wurde von Wissenschaftlern in der Atmosphäre von Titan und Mars entdeckt. In Anbetracht der Tatsache, dass Methan mit der Existenz von Lebewesen verbunden ist erschienen Hypothese von der Existenz des Lebens auf diesen Planeten. Auf Saturn, Jupiter, Neptune, Uranus erschien Methanprodukt als chemische Verarbeitung von Substanzen anorganischen Ursprungs. Auf der Oberfläche unseres Planeten seines geringen Gehalts.
Allgemeine Merkmale
Methan hat keine Farbe, es leichter als Luft ist fast doppelt so hoch ist schlecht in Wasser löslich. Die Zusammensetzung von Erdgas erreicht die Menge 98 Prozent. Der Öldurch Gas enthält 30 bis 90 Prozent Methan. In mehr Methan biologischen Ursprungs.
Huftiere Herbivores Ziegen und Kühe emittieren, um die Verarbeitung in den Mägen von Bakterien eher erhebliche Menge an Methan. Zu den wichtigen Quellen der homologen Reihe von Alkanen wählen Sümpfe, Termiten, Filterung Erdgas Photosynthese der Pflanzen. Bei Nachweis von Spuren von Methan auf dem Planeten, können wir über die Existenz ihres biologischen Leben sprechen.

Verfahren zur Herstellung
Die detaillierte Strukturformel von Methan ist ein Beweis, dass nur in seinem Molekül Einfachbindungen gesättigt Hybridwolken gebildet. Zusätzliche Ausführungsform Laborherstellung von Kohlenwasserstoff – Note mit festem Natriumacetat mit Alkali Legieren und dem Zusammenwirken von Aluminiumcarbid mit Wasser.
Feststoff Methan bläuliche Flamme, während die Reihenfolge von 39 MJ pro Kubikmeter zu belasten. Explosives Gemisch bildet die Substanz an der Luft. Der gefährlichste Methan, die bei unterirdischen Abbau von Mineralvorkommen in den Bergminen freigesetzt wird. Hohe Risiko einer Explosion von Methan und Kohleaufbereitung und Brikettfabriken sowie Sortierindustrie.
physiologische Wirkung
Wenn der prozentuale Anteil von Methan in Luft 5 bis 16 Prozent liegt, kann in Kontakt mit Sauerstoff Methan gezündet werden. Im Fall einer signifikanten Erhöhung der Mischung der chemischen erhöht die Wahrscheinlichkeit einer Explosion.
Wenn die Luftkonzentration des Alkans 43 Prozent ist, ist es die Ursache Erstickungsgefahr.
Mit der Explosion Ausbreitungsgeschwindigkeit von 500 bis 700 Metern pro Sekunde. Sobald Methan mit einer Wärmequelle, Alkan Zündvorgang erfolgt mit einer gewissen Verzögerung in Kontakt gebracht wird.
Es war auf dieser Eigenschaft basiert Produktion von explosionsgeschützte elektrische Anlage und die Sicherheit von Sprengstoffkomponenten.
Da Methan der thermisch stabile gesättigte Kohlenwasserstoff ist, wird es in großem Umfang als industrieller und häuslicher Brennstoff verwendet und auch als ein wertvoller Rohstoff für die chemische Synthese eingesetzt wird. Die Strukturformel von Ethyl-tri-Methan charakterisiert die strukturellen Merkmale der Elemente dieser Klasse von Kohlenwasserstoffen.
Bei dem Verfahren der chemischen Reaktion mit Chlor durch Exposition gegenüber UV-Strahlung kann aus mehreren Reaktionsprodukten gebildet werden. In Abhängigkeit von der Menge an Ausgangsmaterial kann in der Substitution erhalten Chlormethan, Chloroform, Kohlenstofftetrachlorid.
Im Fall einer unvollständigen Verbrennung von Methan gebildet Ruß. Formaldehyd wird im Fall der katalytischen Oxidation gebildet. Das endgültige Reaktionsprodukt ist Kohlenstoffdisulfid mit Schwefel.

Eigenschaften Methan Struktur
Was ist die Strukturformel? Methan bezeichnet gesättigte Kohlenwasserstoffe mit der allgemeinen Formel C n H 2n + 2. Betrachten wir ein bestimmtes Molekül Bildung zu erklären, wie die Strukturformel gebildet wird.
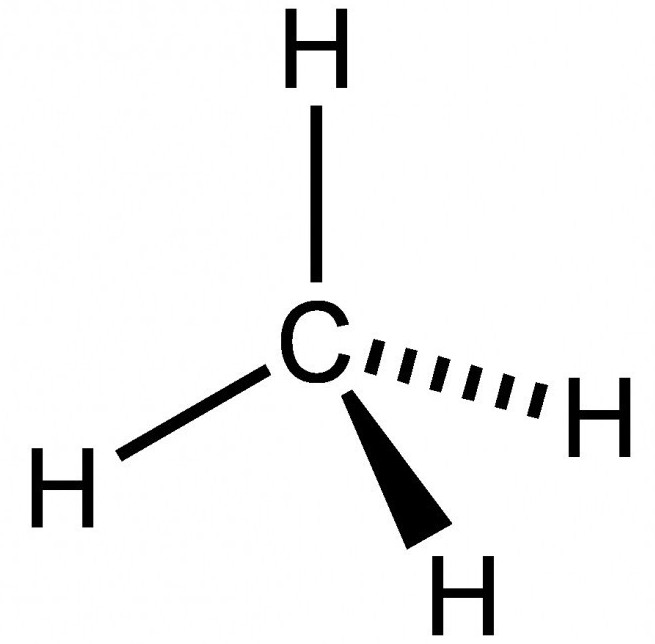
Methan besteht aus einem Kohlenstoffatom und vier Wasserstoffatome miteinander verbunden durch kovalente Bindung Dipolmoment. Wir erklären die Struktur auf der Basis der Strukturformeln Kohlenstoffatomen.
Ansicht Hybridisierung
Die räumliche Struktur von Methan durch tetraedrische Struktur gekennzeichnet. Da außen am Kohlenstoff vier Valenzelektronen tritt Elektronenübergang beim Erhitzen Atom mit einem zweiten S-Orbitale p. Als Ergebnis der letzte Leistungspegel am Kohlenstoff vier ungepaarte ( „frei“) befindet des Elektrons. Vollstrukturformel von Methan ist auf der Tatsache basiert, daß die Bildung der vier Hybrid-Wolken, die in einem Winkel von 109 ° 28 Minuten im Raum orientiert sind, eine Tetraederstruktur bilden. Weiterhin gibt es Vertices hybrid Wolken mit Nicht-Hybrid-Wolken Wasserstoffatome überlappen.
Vollstrukturformel und Kondensmilch Methan voll erfüllt Butlerova Theorie. Zwischen Kohlenstoff und Wasserstoff Formen einfach (single) Bindung, so dass chemische Reaktionen sind nicht typische Verbindung.
Unten ist die ultimative Strukturformel. Methan – ist der erste Vertreter der Klasse der gesättigten Kohlenwasserstoffe, es hat typische Eigenschaften Alkan begrenzen. Strukturformel E und Methan bestätigen die Art der Hybridisierung von Kohlenstoffatom in der organischen Substanz.

Von der Schule Chemiekurs
Diese Klasse von Kohlenwasserstoffen, Vertreter davon ist ein „Sumpfgas“, im Verlauf von 10 Klasse der High School studierte. Zum Beispiel vorgeschlagen Kinder Aufgabe folgende Zeichen: „Schreiben Strukturformeln von Methan“. Es soll selbstverständlich sein, dass nur eine detaillierte strukturelle Konfiguration für diesen Stoff auf Butlerova Theorie lackiert werden.
Seine verkürzte Formel wird das gleiche sein wie die molekularen, in Form von CH4 geschrieben. Unter den neuen Bundesbildungsstandards, die im Zusammenhang mit der Reorganisation der russischen Bildung in der Grundchemiekurs auferlegt werden, beziehen sich alle Angelegenheiten, die die Eigenschaften der Klassen organischer Substanzen, die Überwachung verstehen.
industrielle Synthese
Methan-basierte industrielle Prozesse eine so wichtige chemische Komponente wurden als Acetylen entwickelt. Die Grundlage der thermischen oder elektrischen Cracken Gerade seine Strukturformel. Methan bei der katalytischen Oxidation von Ammoniak Cyanwasserstoffsäure zu bilden.
Wenden Sie dieses organische Material für die Herstellung von Synthesegas. Durch Reaktion mit Dampf, ein Gemisch aus Kohlenmonoxid und Wasserstoff, die Rohstoffe zur Herstellung Grenze sind von einwertigen Alkoholen, Carbonylverbindungen.
Von besonderer Bedeutung ist die Reaktion mit Salpetersäure, was zu Nitromethan.

Die Verwendung als Kraftstoff
Wegen des Mangels an natürlichen Quellen von Kohlenwasserstoffen, sowie die Verarmung der Ressourcenbasis, besonders relevantes Thema auf die neue Suche als (alternative) Quellen für Kraftstoff. Eine solche Option ist Biodiesel, die dort und Methan enthalten.
Aufgrund der Dichteunterschied zwischen dem Benzinkraftstoff und dem ersten Mitglied der Klasse von Alkane, gibt es bestimmte Merkmale in ihrer Anwendung als eine Energiequelle für Kraftfahrzeugmotoren. Um die Notwendigkeit zu vermeiden, eine große Menge an Methan zu tragen, durch Kompression seine Dichte zu erhöhen (bei einem Druck von etwa 250 Atmosphären). Methan in verflüssigtem Zustand in den Zylindern in dem Fahrzeug installiert gespeichert.
Die Exposition gegenüber der Atmosphäre
Wir haben bereits diskutiert, dass Methan Auswirkungen auf den Treibhauseffekt hat. Wenn der Grad der Einwirkung von Kohlenmonoxid (4) auf dem Klima in herkömmlicher Weise als Einheit, dann Fraktion ‚Sumpfgas‘ beträgt 23 Einheiten. In den vergangenen zwei Jahrhunderte haben die Wissenschaftler eine Erhöhung des quantitativen Gehalt an Methan in der Erdatmosphäre zu beobachten.
Derzeit wird die ungefähre Menge von CH4 pro Million auf 1,8 Teile geschätzt. Trotz der Tatsache, dass diese Zahl 200 mal weniger als die Anwesenheit von Kohlendioxid ist, gibt es ein Gespräch zwischen Wissenschaftlern über die mögliche Gefahr von Wärme, die von dem Planeten emittierten Trapping.
Aufgrund der hervorragenden Wärme ‚Sumpfgas‘ ist es bei der Durchführung der chemischen Synthese, sondern auch als Energiequelle nicht nur als Rohstoff verwendet.
Zum Beispiel arbeitet Methan eine Vielzahl von Gas-Heizkessel, Säulen, die für einzelne Heizungsanlagen in Privathäuser und Berghütten.
Ein solche Selbsterwärmung Option ist für Hausbesitzer sehr vorteilhaft, nicht Zusammenhang mit dem Unfall, systematisch in zentralen Heizungsanlagen nehmen. Durch Gaskessel auf einer bestimmten Art von Kraftstoff betrieben wird, ist es ausreichend, für 15-20 Minuten, um vollständig das zweistöckige Haus zu heizen.

Abschluss
Methan, Struktur- und Molekularformeln von denen wurden oben, eine natürliche Energiequelle gegeben. Aufgrund der Tatsache, dass es nur aus Kohlenstoff und Wasserstoffatome enthält, erkennen Umweltschützer die Umweltsicherheit des gesättigten Kohlenwasserstoff.
Unter Standardbedingungen (Lufttemperatur von 20 Grad Celsius und einem Druck von 101325 Pa) der Stoffe gasförmige, nicht-toxische, wasserunlöslich.
Falls die Lufttemperatur auf -161 Grad abgesenkt wird, ist es komprimiert Methan, die in der Industrie häufig verwendet wird.
Methan hat einen Einfluss auf die menschliche Gesundheit. Es ist nicht eine toxische Substanz, aber es ist eine erstickende Gas. Es gibt auch Grenzen (MAC) auf den Gehalt an chemischen Substanzen in der Atmosphäre.
nur in den Fällen erlaubt werden beispielsweise in den Minen zu arbeiten, wo die Menge der zu 300 Milligramm pro Kubikmeter nicht überschreiten. Die Analyse der Merkmale einer Struktur der organischen Stoffe möglich zu schließen, daß die Ähnlichkeiten in der chemischen und physikalischen Eigenschaften mit allen anderen Mitgliedern der Klasse der gesättigten (limit) Kohlenwasserstoffe.
Wir haben die Strukturformel, die räumliche Struktur von Methan analysiert. Homologe Reihen , das „Sumpfgas“ haben die allgemeinen Summenformel C n H 2n + 2 beginnt.