Biochemistry Enzyme. Struktur, Eigenschaften und Funktionen
Die Zelle von jedem lebenden Organismus, Millionen von chemischen Reaktionen stattfinden. Jeder von ihnen ist wichtig, so ist es wichtig, die Geschwindigkeit der biologischen Prozesse auf einem hohen Niveau zu halten. Fast jede Reaktion durch sein Enzym katalysiert. Was sind Enzyme? Welche Rolle spielen sie in einem Käfig?
Enzyme. Definition
Der Begriff „Enzym“ ist aus dem Lateinischen abgeleitet fermentum – Sauerteig. Sie können auch Enzyme aus dem Griechischen en zyme genannt werden – „in großen Sprüngen.“
Enzyme – biologisch aktive Substanzen, so dass jede Reaktion in der Zelle vorkommen, kann nicht ohne sie auskommen. Diese Verbindungen wirken als Katalysatoren. Dementsprechend hat jedes Enzym zwei Haupteigenschaften:
1) Enzym beschleunigt die biochemische Reaktion, aber es wird nicht verbraucht.
2) Der Wert der Gleichgewichtskonstante ändert sich nicht, sondern beschleunigt nur das Erreichen dieses Wertes.
Enzyme beschleunigen biochemische Reaktionen in den Tausenden auf, und in einigen Fällen eine Million Mal. Dies bedeutet, dass in Abwesenheit des Enzymsystems alle intrazellulären Prozesse praktisch zum Stillstand gekommen ist, und die Zelle selbst stirbt. Daher ist die Rolle von Enzymen als Wirkstoffe hoch.
Eine Vielzahl von Enzymen ermöglicht es, den Zellstoffwechsel zu diversifizieren zu regulieren. In jeder Kaskade von Reaktionen Teil viele verschiedene Klassen von Enzymen nehmen. Biologische Katalysatoren haben eine hohe Selektivität durch eine spezifische Konformation des Moleküls. T. To. In den meisten Fällen sind Enzyme Protein in der Natur, sind sie in tertiäre oder quaternäre Struktur. Der Grund dafür ist wieder die Spezifität des Moleküls. 
Die Funktion von Enzymen in der Zelle
Die Hauptaufgabe des Enzyms – Beschleunigung entsprechende Reaktion. Jegliche Kaskadenprozesse, da die Zersetzung von Wasserstoffperoxid und endend Glykolyse, erfordert die Gegenwart eines biologischen Katalysators.
Der ordnungsgemäße Betrieb der Enzyme eine hohe Spezifität zu einem bestimmten Substrat erreicht. Dies bedeutet, dass der Katalysator nur bestimmte Reaktion beschleunigen kann und nicht mehr, auch sehr ähnlich. Durch den Grad der Spezifität des Enzyms nach den Gruppen:
1) Enzyme mit absoluter Spezifität, wenn nur von einer einzigen Reaktion katalysiert. Zum Beispiel verdaut Kollagenase das Kollagen und Maltase spaltet Maltose.
2) Enzyme mit relativer Spezifität. Dazu gehören Substanzen, die eine bestimmte Klasse von Reaktionen, beispielsweise hydrolytische Spaltung katalysieren kann.
Biokatalysator Arbeit beginnt mit der Verbindung seiner aktiven Stelle auf das Substrat. Zur gleichen Zeit, über die ein komplementäres Zusammenwirken ähnlich einen Schlüssel-Schloss sprechen. Dies bezieht sich auf eine vollständige Übereinstimmung mit dem Substrat das aktive Zentrum bildet, die es ermöglicht, die Reaktion zu beschleunigen.
Der nächste Schritt besteht im Verlauf der Reaktion. Seine Geschwindigkeit erhöht sich durch die Wirkung des Enzymkomplexes. Am Ende bekommen wir das Enzym, das mit den Reaktionsprodukten verbunden ist.
Endstadium – entfernen, um die Reaktionsprodukte aus dem Enzym, wonach die aktive Stelle wieder frei für einen weiteren Betrieb wird.
Schematisch ist die Arbeit des Enzyms bei jeder Stufe kann geschrieben werden als:
1) S + E -> SE
2) SE -> SP
3) SP -> S + P, wobei S – ist das Substrat, E – das Enzym, und P – Produkt. 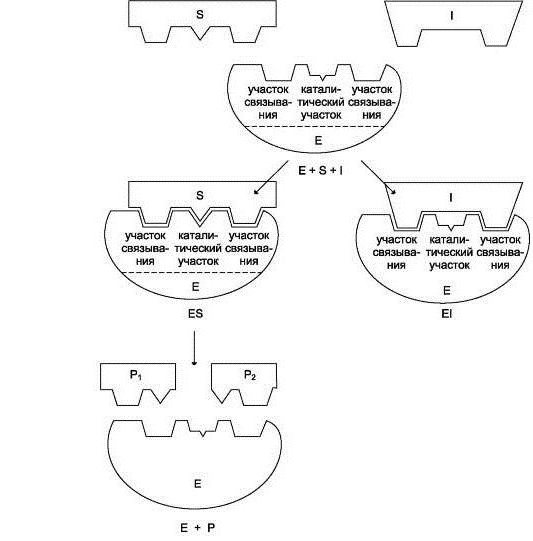
Klassifizierung von Enzymen
Im menschlichen Körper können Sie eine große Anzahl von Enzymen finden. Alles Wissen über ihre Funktionen und Arbeit wurde systematisiert und als Folge gibt es eine gemeinsame Klassifikation, durch die man leicht feststellen kann, was ein bestimmte Katalysator ist. Hier sind sechs Grundklassen von Enzymen, sowie einige Beispiele für Untergruppen.
- Oxidoreduktase.
Enzyme dieser Klasse katalysieren Redox-Reaktionen. Insgesamt erholt 17 Untergruppen. Oxidoreduktasen ist in der Regel nicht-Proteinteil Vitamin oder Häm bereitgestellt.
Unter den Oxidoreduktasen sind gefunden häufig folgende Untergruppen:
a) Dehydrogenase. Biochemistry-Dehydrogenase-Enzym spaltet Wasserstoffatom, und es auf ein anderes Substrat zu übertragen. Diese Untergruppe ist am häufigsten bei den Reaktionen der Atmung, Photosynthese. Im Rahmen der Dehydrogenase ist notwendigerweise in der Form von Coenzym NAD / NADH oder Flavoproteinen FAD / FMN. Oft sind es Metallionen. Beispiele sind Enzyme, wie tsitohromreduktazy, Pyruvat-Dehydrogenase, Isocitrat-Dehydrogenase und auch viele Leberenzyme (Lactat-Dehydrogenase, Glutamat-Dehydrogenase, und so weiter. D.).
b) Oxidasen. Eine Anzahl von Enzymen katalysiert die Zugabe von Sauerstoff zu Wasserstoff, wodurch die Reaktionsprodukte könnten Wasser oder Wasserstoffperoxid (H 2 0, H 2 0 2) betragen. Beispiele für die Enzyme Cytochrom-Oxidase, Tyrosinase.
c) Peroxidase und Katalase – Enzyme, die die Zersetzung H 2 O 2 zu Wasser und Sauerstoff katalysieren.
g) Oxygenase. Diese Biokatalysatoren Sauerstoff Bindung an das Substrat beschleunigen. Dofamingidroksilaza – eines der Beispiele für solche Enzyme.
2. Transferasen.
Target-Enzyme dieser Gruppe ist Transfer von Resten aus der Substanz der Donorsubstanz an den Empfänger.
a) Methyltransferase. DNA – Methyltransferase – Schlüsselenzyme, die den Prozess der Kontrolle der DNA – Replikation. Methylierungs Nukleotide spielt eine wichtige Rolle bei der Regulation von Nukleinsäure-Arbeit.
b) Acyltransferase. Enzyme dieser Untergruppe werden von einem Molekül zum anderen Acylgruppe transportiert. Acyltransferasen Beispiele: Lecithin-Cholesterin-Acyltransferase (funktionelle Gruppe trägt, mit einer Fettsäure auf Cholesterin), lizofosfatidilholinatsiltransferaza (Acylgruppe übertragen Lysophosphatidylcholin).
c) Aminotransferasewerte – Enzyme, die bei der Umwandlung von Aminosäuren beteiligt sind. Beispiele für die Alanin-Aminotransferase-Enzyme, die die Synthese von Alanin aus Pyruvat und Glutamat katalysiert durch eine Aminogruppe zu übertragen.
g) Phosphotransferase. Enzyme katalysieren die Addition von dieser Untergruppe der Phosphatgruppe. Ein anderer Name Phosphotransferase-Kinase, ist häufiger. Beispiele sind Enzyme, wie Hexokinase und Aspartat, die an die Hexose – Phosphat – Reste (meist Glucose) und befestigt sind , Asparaginsäure , respectively.
3. Hydrolasen – eine Klasse von Enzymen, die die Spaltung von Bindungen im Molekül, gefolgt von der Zugabe von Wasser zu katalysieren. Substanzen, die zu dieser Gruppe gehören – die wichtigsten Verdauungsenzyme.
a) Esterasen – die Esterbindungen brechen. Beispiel – Lipasen, die Fette abzubauen.
b) Glycosidasen. Biochemistry Enzyme dieser Serie besteht in der Zerstörung der Glykosid-Bindungen von Polymeren (Oligosaccharide und Polysaccharide). Beispiele: Amylase, Saccharase, Maltase.
c) Peptidase – Enzyme, die den Abbau von Proteinen Aminosäuren katalysieren. Peptidase-verwandte Enzyme, wie Pepsin, Trypsin, Chymotrypsin, karboiksipeptidaza.
g) Amidasen – Amidbindungen spalten. Beispiele: .. Arginase, Urease, Glutaminase usw. Viele Amidase Enzyme finden sich in Ornithin – Zyklus.
4. Lyasen – Enzyme, die für ähnliche Funktionen wie Hydrolasen, jedoch bei der Spaltung von Bindungen in den Molekülen kein Wasser verbraucht wird. Enzyme dieser Klasse haben immer einen Teil von Nicht-Protein-Anteil, beispielsweise in Form von Vitaminen B1 und B6.
a) Decarboxylase. Diese Enzyme wirken an der C-C-Bindung. Beispiele sind Glutaminsäure-Decarboxylase oder Pyruvat Decarboxylase.
b) Hydratase und Dehydratase – Enzyme, die die Spaltung von C-O-Bindungen katalysieren.
c) Die Amidin-Lyasen – Zerstören C-N-Bindung. Beispiel: argininsuktsinatliaza.
g) R-O-Lyase. Derartige Enzyme sind in der Regel eine Phosphatgruppe von einem Trägermaterial abgespalten. Beispiel: Adenylylcyclase. 
Biochemistry von Enzymen auf der Basis ihrer Struktur
Die Fähigkeit jedes Enzyms wird durch die einzelnen bestimmt, nur seine inhärente Struktur. Jedes Enzym – ist in erster Linie Protein und seine Struktur und der Grad der Faltung eine entscheidende Rolle spielen seine Funktion bei der Bestimmung.
Jede Biokatalysator wird durch die Anwesenheit des aktiven Zentrums charakterisiert, die sich wiederum in mehrere verschiedene Funktionsbereiche unterteilt ist:
1) Catalytic Center – eine spezielle Region des Proteins, in dem das Enzym Haftung an dem Substrat. In Abhängigkeit von der Konformation des Proteinmolekül katalytischen Zentrums kann eine Vielzahl von Formen annehmen, die auf das Substrat sowie ein Schloss und Schlüssel entsprechen. Eine solche komplexe Struktur erklärt, warum das Enzymprotein in der tertiären oder quaternären Zustand befindet.
2) Adsorption Zentrum – dient als „Halter“. Dabei wird zunächst die gesamte Kommunikation findet statt zwischen dem Enzym-Moleküle und dem Substratmolekül. Jedoch, dass die Verbindung die Adsorption Zentrum bildet, sehr schwach, und damit die katalytische Reaktion in dieser Phase reversibel.
3) allosterische Zentren können im aktiven Zentrum und über die gesamte Oberfläche des Enzyms lokalisiert sein. Ihre Funktion – Regulation des Enzyms. Die Regelung erfolgt über Moleküle Inhibitoren und Aktivatoren Moleküle.
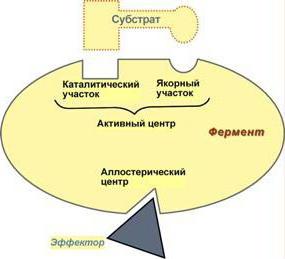
Die Aktivator-Proteine an das Enzymmolekül zu binden, beschleunigen seinen Betrieb. Inhibitoren, im Gegenteil, hemmen die katalytische Aktivität, und dies auf zwei Arten erfolgen: entweder das Molekül bindet an dem allosterischen mittleren Bereich des aktiven Zentrums des Enzyms (kompetitive Hemmung), oder es in einer anderen Region des Proteins (nicht kompetitive Hemmung) angebracht ist. Die kompetitive Hemmung wird effektiver betrachtet. Nachdem auf diese Weise geschlossenen Raum für das Substrat an das Enzym zu binden, und dieses Verfahren ist im Fall von praktisch vollständiger Koinzidenz des Inhibitormoleküls und bildet ein aktives Zentrum nur möglich.
Enzym oft nicht aus Aminosäuren bestehen, sondern auch aus anderen organischen und anorganischen Substanzen. Dementsprechend isoliert Apoenzym – proteinischen Teil Coenzyms – organischer Rest und Kofaktor – anorganischer Teil. Co-Enzym kann ulgevodami, Fette, Nukleinsäuren, Vitamine dargestellt werden. Im Gegenzug, der Co-Faktor – ist oft eine tragende Metallionen. Die Enzymaktivität wird durch seine Struktur bestimmt: zusätzliche Substanzen in der Zusammensetzung enthalten, katalytische Eigenschaften verändern. Verschiedene Arten von Enzymen – ist das Ergebnis einer Kombination all dieser Faktoren einen Komplex bilden. 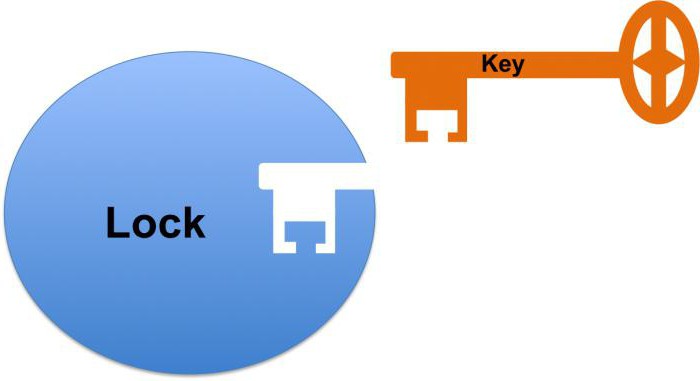
Regulierung der Arbeit von Enzymen
Enzyme als die biologisch aktive Substanz nicht immer notwendig für den Körper ist. Biochemie von Enzymen ist, dass sie können im Falle einer übermäßigen Katalyse Schaden lebenden Zellen. Um zu verhindern, schädliche Auswirkungen auf den Körper notwendigen Enzyme, um irgendwie ihre Arbeit zu regulieren.
T. To. Enzyme sind Protein in der Natur, sie werden bei hohen Temperaturen leicht zerstört. Denaturierung Prozess ist reversibel, aber es kann deutlich die Substanz beeinflussen.
pH-Wert spielt auch eine wichtige Rolle bei der Regulierung. Maximale Enzymaktivität bei einem neutralen pH-Wert (7,0-7,2) allgemein beobachtet. Auch hat Enzyme, die nur unter sauren Bedingungen arbeiten oder nur in alkalisch. So wird in den zellulären Lysosomen gehalten niedrigen pH-Wert, bei denen die maximale Aktivität hydrolytischer Enzyme. Im Fall eines versehentlichen Kontakts mit dem Zytoplasma, wo die Umwelt näher zu neutral ist, wird ihre Aktivität verringern. Ein solcher Schutz von „samopoedaniya“ basiert auf den Merkmalen der Hydrolase basiert.
Es lohnt sich über die Bedeutung von Coenzym und Kofaktor in der Zusammensetzung der Enzyme zu erwähnen. Das Vorhandensein von Vitaminen oder Metallionen signifikant die Funktion einiger spezifischer Enzyme beeinflussen. 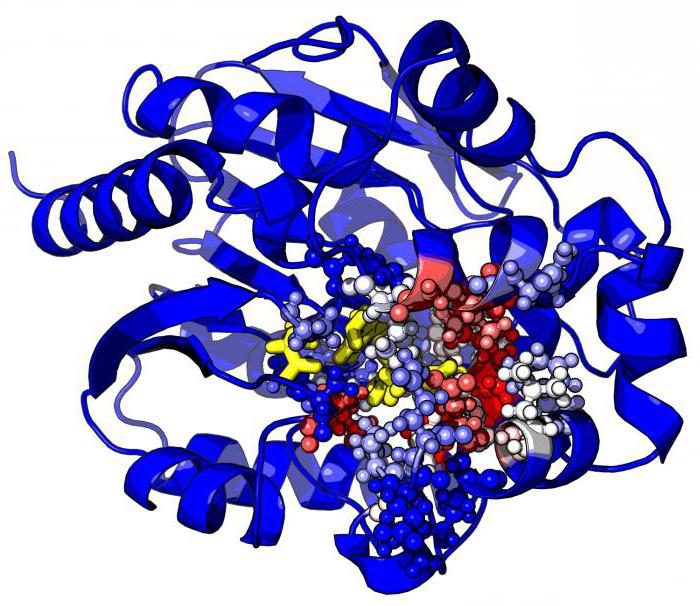
Nomenklatur von Enzymen
Alle Enzyme des Körpers sind nach ihrer genannt einem der Klassen gehören, sowie das Substrat, mit denen sie reagieren. Manchmal die systematische Nomenklatur verwendet , nicht ein , sondern zwei des Substrats im Titel.
Beispiele für Namen einiger Enzyme:
- Leberenzyme: Lactat degidrogen aza-Glutamat-aza-degidrogen.
- Vollständiger systematischer Name des Enzyms: Lactat + NAD-Aza -oksidoredukt.
Konservierte und Trivialnamen, die die Regeln der Nomenklatur nicht einhalten. Beispiele sind Verdauungsenzyme: Trypsin, Chymotrypsin, Pepsin.
Das Verfahren der Synthese von Enzymen
Die Funktionen der Enzyme werden auch auf genetischer Ebene bestimmt. Da das Molekül im Großen und Ganzen -. Protein, und seine Synthese ist genau die gleiche wie die Prozesse der Transkription und Translation.
Syntheseenzyme tritt wie folgt auf. Zunächst las DNA Informationen über das gewünschte Enzym mRNA zu bilden. Messenger-RNA alle Aminosäuren, die einen Teil des Enzyms sind. Regulation der Enzyme kann auch auf DNA-Ebene auftreten, wenn das Produkt der Reaktion genügend Gentranskription Anschläge katalysierte und im Gegenteil, wenn es eine Notwendigkeit in dem Produkt ist, ist es aktiviert den Transkriptionsprozess.
Rundfunk – Sobald die mRNA im Zytoplasma, die nächste Phase freigegeben. An Ribosomen endoplasmatischen Retikulum synthetisiert Primärkette , bestehend aus Aminosäuren , die durch Peptidbindungen verbunden Säuren. Allerdings kann das Proteinmolekül in der Primärstruktur noch nicht seine enzymatische Funktion auszuführen.
Die Enzymaktivität ist auf Proteinstrukturen abhängig. Gleiche EPS Protein auftritt Verdrehen, wodurch erste sekundäre und dann tertiäre Struktur bilden. Die Synthese einiger Enzyme wird in diesem Stadium angehalten, aber die Katalysatoraktivität zu verbessern, ist häufig notwendig, Befestigung und Cofaktor Coenzym.
In bestimmten Bereichen des endoplasmatischen Retikulums kommt organische Komponenten des Enzyms gebunden: Zucker, Nukleinsäuren, Fette und Vitamine. Einige Enzyme können nicht ohne die Anwesenheit des Co-Enzym arbeiten.
Cofaktor spielt eine entscheidende Rolle bei der Bildung der quartären Struktur des Proteins. Einige der Funktionen von Enzymen sind nur verfügbar, wenn die Proteindomäne Organisation. Daher ist es sehr wichtig, ihre Anwesenheit Quartärstruktur, bei dem ein Verbindungsglied zwischen mehrer Proteinkügelchen ein Metallion ist. 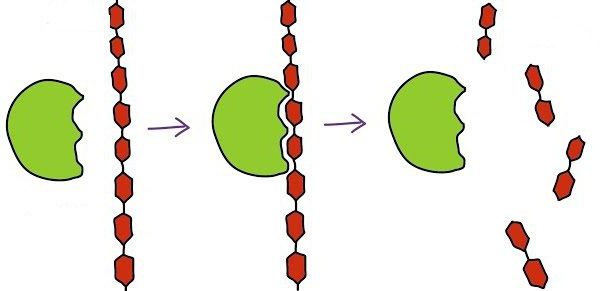
Mehrere Formen von Enzymen
Es gibt Situationen, in denen es das Vorhandensein mehrerer Enzyme notwendig ist, welche die gleiche Reaktion katalysieren, aber in mancher Hinsicht voneinander unterscheiden. Zum Beispiel kann das Enzym bei 20 Grad arbeiten, aber bei 0 Grad, so wird er nicht in der Lage sein, seine Funktionen auszuführen. Was bei niedrigen Temperaturen in einer solchen Situation den lebenden Körper zu tun?
Dieses Problem wird durch das Vorhandensein mehrerer Enzyme leicht gelöst, die die gleiche Reaktion katalysieren, aber in unterschiedlichen Arbeitsbedingungen. Es gibt zwei Arten von mehreren Formen von Enzymen:
- Isoenzyme. Solche Proteine, die von verschiedenen Genen kodiert werden, werden sie von verschiedenen Aminosäuren zusammengesetzt, aber die gleiche Reaktion katalysieren.
- Wahre mehrere Formen. Diese Proteine werden aus dem gleichen Gen transkribiert werden, sondern tritt an Ribosomen Modifikation Peptiden. Am Ausgang erzeugt verschiedene Formen des gleichen Enzyms.
Als Ergebnis wird, um mehr Formen des ersten Typs auf der genetischen Ebene gebildet wird, wenn die zweite – auf den posttranslationalen.
Bedeutung Enzyme
Die Verwendung von Enzymen in der Medizin kommt zur Ausgabe neuer Medikamente nach unten, im Rahmen derer die Substanzen bereits in der richtigen Menge sind. Wissenschaftler haben noch nicht einen Weg zu stimulieren die Synthese von fehlenden Enzyme im Körper gefunden, aber jetzt weit verbreitet Medikamente, die für die Dauer ihres Nachteil ausgleichen kann.
Verschiedene Enzyme in einer Zelle große Anzahl von Reaktionen auf die Erhaltung des Lebens in Bezug zu katalysieren. Einer dieser Vertreter sind enizmov Nukleasen Gruppe: Endonuclease und Exonuclease. Ihre Arbeit ist ein konstantes Niveau von Nukleinsäuren in einer Zelle, die Entfernung von beschädigter DNA und RNA zu erhalten.
Nicht über das Phänomen der Blutgerinnung vergessen. Als eine wirksame Schutzmaßnahme, wird der Prozeß durch eine Reihe von Enzymen gesteuert. Leiter unter ihnen ist Thrombin, das Fibrinogen in Fibrin aktiv inaktives Protein umwandelt. Sein Faden entsteht eine Art Netzwerk, das die Gefäßverletzungsstelle verschließt, wodurch übermäßigen Blutverlust zu verhindern.
Enzyme werden bei der Weinbereitung, brauen, Produktion vieler Milchprodukten verwendet. Für Alkohol aus Glucose Hefe verwendet werden können, aber, und für ein erfolgreiches Auftreten dieses Prozesses genug von ihnen extrahieren. 
Interessante Fakten über die hast du nicht wissen
– alle Enzyme des Körpers haben eine riesige Masse – 5.000 bis 1.000.000 Da. Dies ist auf das Vorhandensein von Protein im Molekül. Zum Vergleich wird das Molekulargewicht der Glucose – 180 Ja, und Kohlendioxid – insgesamt 44 Ja.
– Bis heute geöffnet mehr als 2000 Enzyme, die in den Zellen von verschiedenen Organismen zu finden sind. Allerdings sind die meisten dieser Substanzen noch nicht vollständig verstanden.
– Die Enzymaktivität wird für den Erhalt wirksame Waschpulver verwendet. Hier erfüllen Enzyme die gleiche Rolle wie im Körper: sie brechen organische Stoffe, und diese Eigenschaft hilft zu bekämpfen Flecke. Es wird empfohlen, bei einer Temperatur von nicht höher als 50 Grad, eine solche Reinigungsmittel zu verwenden, sonst wird es zu dem Denaturierung Prozess gehen kann.
– Laut Statistik 20% der Menschen weltweit leiden unter dem Mangel an einem der Enzyme.
– über die Eigenschaften für eine lange Zeit bekannt, Enzym, aber nur im Jahr 1897 erkannte man, dass nicht die Hefe, und ein Auszug aus ihren Zellen kann für die Fermentation von Zucker in Alkohol verwendet werden.












