Was ist die Wertigkeit von Schwefel? Mögliche Valenzen des Schwefels
Schwefel (lat Schwefel.) – Nichtmetall-Element. Die chemische Symbol S, die Seriennummer im Periodensystem – 16 Valence Schwefel eingestellt wurde, noch bevor die Struktur des Atoms zu studieren. Sein Wert wird basierend auf Eigenschaften Ersatz bestimmt, die Besucher oder eine Reihe anderer Atome oder Gruppen anhängen. Später fanden die Forscher eine Rolle von negativ geladenen Teilchen (Elektronen) im Falle einer chemischen Bindung.
Valence Schwefel: die bestimmte Atome beeinflusst seinen Wert?
Die meisten chemischen Elemente auf der Erde sind am 16. Platz. Es kommt in Form von hellgelben Kristalle oder Pulver in den Felsen in der Nähe von aktiven und inaktiven Vulkanen. Die bekanntesten natürlichen Verbindungen – Sulfide und Sulfate.

Eigenschaften der Elemente und Stoffe:
- Starke Nichtmetall.
- Durch Elektronegativität (EO) oder die Fähigkeit, Elektronen Schwefelausbeuten nur Fluor, Sauerstoff, Stickstoff, Chlor und Brom zu gewinnen.
- Es reagiert mit Metallen und Nichtmetallen, einfachen und komplexen Verbindungen.
Die Unterschiede in den Eigenschaften hängen von der Struktur und der Zustand des Atoms, der Unterschied in den Werten von EO. Lassen Sie uns sehen, was in einer Wertigkeit von Schwefelverbindungen sein können. Ihre chemischen Verhalten hängen von der Struktur des Strom Briefumschlägen, die Anzahl und die Anordnung der äußeren Elektronen im Atom.
Warum ist Valenz anders?
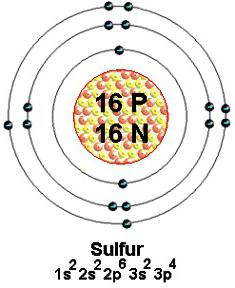 Stabile Isotope sind natürliche Schwefel mit Massenzahlen von 32 (am häufigsten), 33, 34 und 36. Jedes dieses Atom Nuklide 16 positiv geladene Protonen enthalten. In dem Raum, in der Nähe des Kerns mit enormer Geschwindigkeit von 16 Elektronen bewegen. Sie sind unendlich klein, negativ geladen. Weniger an den Kern (lockeren) 6 externen Partikel angezogen. Mehrere oder alle von ihnen sind bei der Bildung von verschiedenen Arten von chemischer Bindung beteiligt. Nach modernen Konzepten Valenz von Schwefel wird durch die Anzahl der geschaffenen gemeinsamen (bonding) Elektronenpaare bestimmt. Gewöhnlich Illustrationen externen Partikel in dem Verfahren beteiligt, dargestellt durch einen Punkt, um eine chemische Symbol.
Stabile Isotope sind natürliche Schwefel mit Massenzahlen von 32 (am häufigsten), 33, 34 und 36. Jedes dieses Atom Nuklide 16 positiv geladene Protonen enthalten. In dem Raum, in der Nähe des Kerns mit enormer Geschwindigkeit von 16 Elektronen bewegen. Sie sind unendlich klein, negativ geladen. Weniger an den Kern (lockeren) 6 externen Partikel angezogen. Mehrere oder alle von ihnen sind bei der Bildung von verschiedenen Arten von chemischer Bindung beteiligt. Nach modernen Konzepten Valenz von Schwefel wird durch die Anzahl der geschaffenen gemeinsamen (bonding) Elektronenpaare bestimmt. Gewöhnlich Illustrationen externen Partikel in dem Verfahren beteiligt, dargestellt durch einen Punkt, um eine chemische Symbol.
Als Wertigkeit hängt des Atoms auf die Struktur insgesamt?
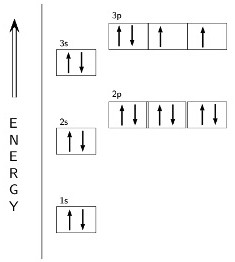 Mit der Struktur können Ebenen und Unterebenen (s, p, d) zeigen das Energiediagramm verwendet, aus dem die Valenz von Schwefel abhängigen Formel ist. Zwei entgegengesetzt gerichtete Pfeile symbolisieren gepaart, einer – ungepaarte Elektronen. Der Außenraum Schwefelatom Orbitale Form von Partikeln 6 und 8 ist für die Stabilität der Oktetts Regel notwendig. Valenzschale Konfiguration spiegelt Formel 3s23p4. Elektronen unvollendet Schicht eine große Reserve an Energie, die den instabilen Zustand des Atoms verursacht. Um die Stabilität des Schwefelatoms zu erzielen, erfordert zwei zusätzliche negative Teilchen. Sie können während der Bildung erhalten werden , kovalente Bindungen mit anderen Elementen oder aufgrund der Absorption von zwei freien Elektronen. In diesem Fall Schwefel ist eine Wertigkeit II (-). Der gleiche Wert kann unter Verwendung der Formel erhalten werden: 8 – 2 = 6, wobei 6 – ist die Gruppennummer in der das Element.
Mit der Struktur können Ebenen und Unterebenen (s, p, d) zeigen das Energiediagramm verwendet, aus dem die Valenz von Schwefel abhängigen Formel ist. Zwei entgegengesetzt gerichtete Pfeile symbolisieren gepaart, einer – ungepaarte Elektronen. Der Außenraum Schwefelatom Orbitale Form von Partikeln 6 und 8 ist für die Stabilität der Oktetts Regel notwendig. Valenzschale Konfiguration spiegelt Formel 3s23p4. Elektronen unvollendet Schicht eine große Reserve an Energie, die den instabilen Zustand des Atoms verursacht. Um die Stabilität des Schwefelatoms zu erzielen, erfordert zwei zusätzliche negative Teilchen. Sie können während der Bildung erhalten werden , kovalente Bindungen mit anderen Elementen oder aufgrund der Absorption von zwei freien Elektronen. In diesem Fall Schwefel ist eine Wertigkeit II (-). Der gleiche Wert kann unter Verwendung der Formel erhalten werden: 8 – 2 = 6, wobei 6 – ist die Gruppennummer in der das Element.
Wo gibt es Verbindungen, bei denen die Wertigkeit von Schwefel II (-)?
 Element zieht oder vollständig nimmt Elektronen von Atomen mit einem niedrigen Wert Elektronegativität nach Pauling-Skala. Valenz II (-) wird in Sulfiden von Metallen und Nichtmetallen gezeigt. Eine umfangreiche Gruppe solcher Verbindungen ist in der Zusammensetzung gefunden von Gesteinen und Mineralien sind von großer praktischer Bedeutung. Dazu gehören Pyrit (FeS), Sphalerit (ZnS), Galenit (PbS) und andere Substanzen. Eisensulfid-Kristalle haben eine schöne Bräune Farbe und Glanz. „Ein Schatz zum Verlieben“ Mineral Pyrit oft genannt wird. Bei Metallen aus ihren Erzen durch Kalzinieren oder Reduktion. Schwefelwasserstoff H2S hat die gleichen elektronischen Strukturen, wie zum Beispiel Wasser. Der Ursprung von H2S:
Element zieht oder vollständig nimmt Elektronen von Atomen mit einem niedrigen Wert Elektronegativität nach Pauling-Skala. Valenz II (-) wird in Sulfiden von Metallen und Nichtmetallen gezeigt. Eine umfangreiche Gruppe solcher Verbindungen ist in der Zusammensetzung gefunden von Gesteinen und Mineralien sind von großer praktischer Bedeutung. Dazu gehören Pyrit (FeS), Sphalerit (ZnS), Galenit (PbS) und andere Substanzen. Eisensulfid-Kristalle haben eine schöne Bräune Farbe und Glanz. „Ein Schatz zum Verlieben“ Mineral Pyrit oft genannt wird. Bei Metallen aus ihren Erzen durch Kalzinieren oder Reduktion. Schwefelwasserstoff H2S hat die gleichen elektronischen Strukturen, wie zum Beispiel Wasser. Der Ursprung von H2S:
- wird während des Zerfalls von Proteinen (z.B. Hühnereiern) freigesetzt;
- Es bricht mit vulkanischen Gasen;
- Es reichert sich in natürlichen Gewässern, Öl;
- in der Erdkruste in die Hohlräume freigesetzt.
Warum ist die Formel valenten Schwefeloxid SO2?
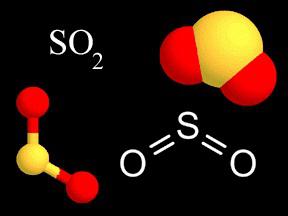 Dioxide Formel zeigt an, daß ein Schwefelatom in einem Molekül gebunden an zwei Sauerstoffatome, von denen jede 2 bis Elektronenoktett sein muss. Die resultierende Bindung ist von Natur aus einer polaren kovalente (EO mehr Sauerstoff). Die Valenz des Schwefels in dieser Verbindung weist einen Wert von IV (+), da das Schwefelatom Elektronen 4 in Richtung der beiden Sauerstoffatome versetzt sind. Die Formel kann wie folgt geschrieben werden: S2O4, aber nach den Vorschriften von 2. dioxid reduziert werden, wenn in Wasser bildet schweflige Säure Ionen gelöst sind schwach. Ihre Salze – Sulfite – starke Reduktionsmittel. SO2 Gas ist ein Zwischenprodukt bei der Herstellung von Schwefelsäure.
Dioxide Formel zeigt an, daß ein Schwefelatom in einem Molekül gebunden an zwei Sauerstoffatome, von denen jede 2 bis Elektronenoktett sein muss. Die resultierende Bindung ist von Natur aus einer polaren kovalente (EO mehr Sauerstoff). Die Valenz des Schwefels in dieser Verbindung weist einen Wert von IV (+), da das Schwefelatom Elektronen 4 in Richtung der beiden Sauerstoffatome versetzt sind. Die Formel kann wie folgt geschrieben werden: S2O4, aber nach den Vorschriften von 2. dioxid reduziert werden, wenn in Wasser bildet schweflige Säure Ionen gelöst sind schwach. Ihre Salze – Sulfite – starke Reduktionsmittel. SO2 Gas ist ein Zwischenprodukt bei der Herstellung von Schwefelsäure.
Welche Stoffe Schwefel zeigt seine höchste Wertigkeit?
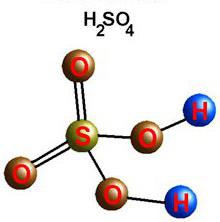 Oxide oder SO3 S2O6 – farblose Flüssigkeit bei Temperaturen unter 17 ° C, härtet. In der Verbindung der SO3 die Valenz von Sauerstoff II (-) und VI (+) Schwefel. Höherer Oxid löst es in Wasser und bildet einen starken zweibasischen Schwefelsäure. Für eine große Rolle im Produktionsprozess eine Substanz, „das Brot der chemischen Industrie“ genannt. Wichtige Rolle in der Wirtschaft und Medizin gehört Säuresalze – Sulfate. Verwenden hydratisiertes Calcium (Gips), Natrium (Glaubersalz), Magnesium (Englisch oder Bittersalz).
Oxide oder SO3 S2O6 – farblose Flüssigkeit bei Temperaturen unter 17 ° C, härtet. In der Verbindung der SO3 die Valenz von Sauerstoff II (-) und VI (+) Schwefel. Höherer Oxid löst es in Wasser und bildet einen starken zweibasischen Schwefelsäure. Für eine große Rolle im Produktionsprozess eine Substanz, „das Brot der chemischen Industrie“ genannt. Wichtige Rolle in der Wirtschaft und Medizin gehört Säuresalze – Sulfate. Verwenden hydratisiertes Calcium (Gips), Natrium (Glaubersalz), Magnesium (Englisch oder Bittersalz).
Die Bildung von verschiedenen Arten der chemischen Bindung teilnehmen kann 1, 2, 3, 4, 6, die äußeren Elektronen. Wir nennen die Valenz möglich, Schwefel, gegeben, dass es selten und instabile Verbindung: I (-), II (-), II (+), III (+), IV (+), VI (+). Eine zweite positive Valenz Element erwirbt monoxide SO. Der häufigste Wert II (-), IV (+), VI (+) zeigt Schwefel in der Zusammensetzung der Gruppe von Substanzen mit industrieller, landwirtschaftlicher und medizinischer Bedeutung. Seine Verbindungen werden bei der Herstellung von Feuerwerk verwendet.

Das große Problem ist die Erfassung von Abgasen, einschließlich schädlich für Menschen und Umwelt von Schwefeloxiden IV (+), VI (+ ) und Schwefelwasserstoff. Etablierte Technik für die Verarbeitung dieser Abgase und sie aus den Schwefelsäure Sulfaten erhalten wird. Zu diesem Zweck Chemieanlagen in der Nähe von Stahlwerken oder in der Umgebung errichtet. Als Ergebnis wird die Menge an Verunreinigung reduziert wird, gibt es weniger „Schwefelsäure regen.“