Eigenschaften von Schwefel. Die Anwendung von Schwefel. Medizinischer Schwefel
Chalkogene – Gruppenelemente bezieht sich auf eine Schwefel. Sein chemisches Symbol – S – der erste Buchstabe des lateinischen Namen des Schwefels. Zusammensetzung einfache Substanz mit diesem Symbol ohne Index aufgenommen. Betrachten Sie die wichtigsten Punkte in Bezug auf die Struktur, Eigenschaften, Herstellung und Verwendung dieses Elements. Schwefel Funktionen werden im Detail wie möglich dargestellt werden.
Gemeinsamkeiten und Unterschiede Chalkogen
Schwefel handelt sich um eine Untergruppe von Sauerstoff. Dies ist das 16. Team in der modernen Langperiode bilden das Bild des Periodensystems (PS). Veraltete Zimmer und Index – VIA. Die Namen der chemischen Elemente aus der Gruppe, die chemischen Symbole:
- Sauerstoff (O);
- Schwefel (S);
- Selen (Se);
- Tellur (Te);
- Polonium (Po).
Die äußeren Elektronenschale Elemente oberhalb derselben angeordnet sind. Es enthält alle sechs Valenzelektronen , die bei der Bildung von chemischen Bindungen mit anderen Atomen teilnehmen. Wasserstoffverbindungen haben die Struktur H 2 R, beispielsweise H 2 S – Schwefelwasserstoff. Die Namen der chemischen Elemente mit Sauerstoff zwei Arten von Verbindungen bilden: Schwefel, Selen und Tellur. Allgemeine Formeln Oxide dieser Elemente – RO 2, RO 3.
Chalcogen entsprechen einfache Substanzen, die stark in der physikalischen svostvam unterscheiden. Die am häufigsten in der Erdkruste aller Chalkogen – Sauerstoff und Schwefel. Das erste Element definiert zwei Gase, die zweiten – die Feststoffe. Polonium – das radioaktive Element – selten in der Erdkruste. In der Gruppe von Sauerstoff zu Polonium metallischer Eigenschaften Abnahme und Zunahme des Metalls. Zum Beispiel Schwefel – typischer Nichtmetall- und Tellur hat einen metallischen Glanz und elektrische Leitfähigkeit.

№ Element 16 des Periodensystems DI Mendelejew
Die relative Atomgewicht Schwefel – 32,064. Der häufigsten natürlichen Isotopen 32 S (mehr als 95 Gewichts-%). Gefunden in kleineren Mengen Nuklide mit Atommasse von 33, 34 und 36. Kennzeichnend für Schwefel auf die Situation in der SS und die atomare Struktur:
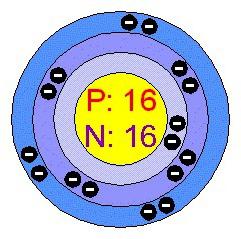
- Seriennummer – 16;
- Ladung des Atoms 16;
- Atomradius – 0.104 nm;
- Ionisierungsenergie von -10,36 eV;
- relativ Elektronegativität – 2,6;
- der Oxidationsgrad in den Verbindungen – +6, +4, +2, -2;
- Valenz – II (-), II (+), IV (+), VI (+).
Schwefel ist in der dritten Periode; Die erste – 2, die zweite – 8, – die dritten 6. Valenzelektronen sind alle extern: Elektronen in einem Atom sind an drei Energieniveaus befinden. Wenn mit Elementen elektro Schwefel in Wechselwirkung gibt 4 oder 6 Elektronen, +6 typische Oxidationsstufe erwerben, +4. Die Umsetzungen mit Wasserstoff und einem Metallatom zieht Elektronen zwei Bytes fehlen zu füllen und stabilen Zustand zu erreichen. Die Oxidation wird in diesem Fall auf -2 abgesenkt.
Die physikalischen Eigenschaften des rhombischen und monoklinem allotropen Formen
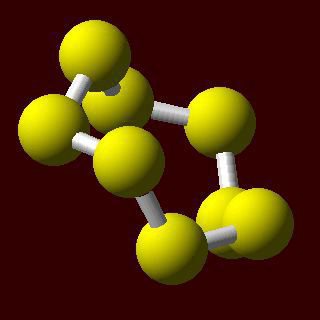
Unter normalen Bedingungen werden die Schwefelatome zusammen in stabiler Schaltung in einem Winkel verbunden ist. Sie können in einem Ring geschlossen sein, die die Existenz von cyclischen Schwefelmolekülen nahe legt. Zusammensetzung der Formel reflektiert S 6 und S 8.
Schwefel Merkmale müssen Beschreibung der Unterschiede zwischen allotropen Modifikationen ergänzt werden mit unterschiedlichen physikalischen Eigenschaften.
Rhombic oder α-Schwefel – die stabilste kristalline Form. Diese helle gelbe Kristalle, die aus Molekülen S 8. rhombische Schwefel Dichte beträgt 2,07 g / cm3. Hellgelbe Kristalle der monoklinen Form β gebildete Schwefel bei einer Dichte von 1,96 g / cm3. Siedepunkt erreicht 444,5 ° C
Herstellung von amorphem Schwefel
Welche Farbe ist Schwefel in einem plastischen Zustand? Dies ist eine dunkelbraune Masse, ganz ähnlich wie die gelben Pulver oder Kristalle. Um es zu erhalten, müssen Sie die rhombischen oder monokliner Schwefel schmelzen. Bei Temperaturen oberhalb von 110 ° C eine Flüssigkeit gebildet werden, während die weitere Erwärmung dunkelt es bei 200 ° C dick und zähflüssig wird. Wenn schnell den geschmolzenen Schwefel in kaltes Wasser gegossen, härtet es Zick-Zack – Ketten zu bilden, die Struktur der Formel S n entspricht.

Die Löslichkeit des Schwefels
Einige Modifikationen einer Substanz, löslich in Kohlenstoffdisulfid, Benzol, Toluol oder flüssiges Ammoniak. Wenn langsam abgekühlt, organische Lösungen werden dann monokliner Schwefel Nadeln gebildet. Für die Verdampfung von Flüssigkeiten stehen klar zitronengelbe Kristalle des rhombischen Schwefels. Sie sind zerbrechlich, können sie leicht zu einem Pulver zermahlen werden. Schwefel ist in Wasser unlöslich. Die Kristalle sinken auf den Boden des Behälters, und das Pulver auf der Oberfläche schwimmen kann (nicht benetzbar).
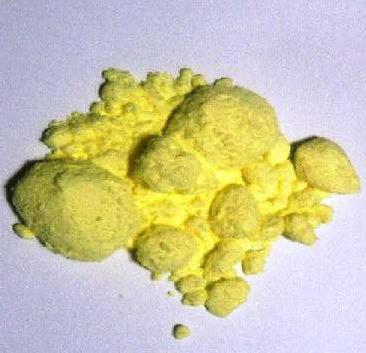
chemische Eigenschaften
Die Reaktionen werden gezeigt typische nichtmetallisches Element Eigenschaften № 16:
- Schwefel oxydiert Metallen und Wasserstoff, wird auf S verringert 2- Ion;
- die Verbrennung der Luft und Sauerstoff sind di- und Schwefeltrioxid, erzeugt, die Säureanhydride sind;
- durch Reaktion mit einer anderen elektro Element – Fluor – Schwefel verliert auch seine Elektronen (oxidieren).
Freie Schwefel in der Natur
Da die Prävalenz von Schwefel in der Kruste ist der Erde am 15. Platz unter den chemischen Elementen. Der durchschnittliche Gehalt an S – Atomen in Gestein und Mineralien 0,05 Gewichts-% der Kruste.
Welche Farbe ist Schwefel in der Natur (nativ)? Dieses hellgelbe Pulver mit charakteristischem Geruch oder gelber Kristalle mit einem Glasglanz aufweist. Einlagen in Form von Einlagen, die kristallinen Schichten von Schwefel in den Bereichen der alten und modernen Vulkanismus in Italien, Polen, dem Mittleren Osten, Japan, Mexiko, USA gefunden. Oft ist die Extraktion von Drusen ist eine schöne und riesige Einkristallen.
Schwefelwasserstoff und Oxide in der Natur
In Vulkanregionen sind auf der Oberfläche der gasförmigen Schwefelverbindung entfernt. Schwarzes Meer in einer Tiefe von mehr als 200 m ist lebloses wegen der Trennung von Schwefelwasserstoff H 2 S. Die Formel zweiwertiger Schwefeloxid – SO 2, dreiwertigen – SO 3. Diese gasförmigen Verbindungen sind in der Zusammensetzung von einigen der Öl-, Gas-, natürlichen Gewässern. Schwefel wird in der Zusammensetzung der Kohle enthält. Es ist notwendig, für den Bau von vielen organischen Verbindungen. Wenn Fäulnis von Proteinen von Hühnerei Schwefelwasserstoff freigesetzt, so ist es oft gesagt, dass der Gas Geruch nach faulen Eiern. Schwefel gehört zu den biogenen Elemente, ist es notwendig für das Wachstum und die Entwicklung des Menschen, Tieren und Pflanzen.

Bedeutung der natürlichen Sulfide und Sulfate
Eigenschaften des Schwefels werden unvollständig, wenn nicht sagen, dass das Element nicht nur in Form einer einfachen Substanz und Oxid zu finden ist. Die häufigsten natürlichen Verbindungen – ein Salz der Schwefelsäure und Schwefelwasserstoff. Sulfide von Kupfer, Eisen, Zink, Quecksilber, Blei, das in der Zusammensetzung der Mineralien Chalcopyrit, Pyrit, Sphalerit, Galenit und Zinnober gefunden. Von Sulfaten können in der Natur Mineralien und Gesteinen (Mirabilit, Gips, Selenit, Schwerspat, Kieserit, Epsomit) bilden, erwähnt werden, Natrium-, Calcium-, Barium- und Magnesiumsalze, die. Alle diese Verbindungen in verschiedenen Bereichen der Wirtschaft eingesetzt werden, werden als Rohstoffe für die industrielle Verarbeitung, Düngemittel, Baustoffe verwendet. Großer medizinischer Wert bestimmter kristallin.
Empfang
gelbe Substanz in dem freien Zustand tritt in unterschiedlichen Tiefen in der Natur. Falls erforderlich, wird der Schwefel aus Gesteinen geschmolzen , ohne sie auf die Oberfläche zu erhöhen, während die Tiefe von überhitztem Pump Dampf und Druckluft. Ein weiteres Verfahren umfasst die Sublimation von Gesteinsmehl in speziellen Öfen. Andere Verfahren beinhalten die Auflösung von Schwefelkohlenstoff oder Flotation.
Anforderungen der Industrie Schwefel groß, so dass die elementare Substanz verwendete Verbindung zu erhalten. Der Schwefelwasserstoff und Schwefelsulfid ist in der reduzierten Form. Der Oxidationszustand des Elements ist gleich -2. Schwefeloxidation wird durch Erhöhung um den Wert 0. Zum Beispiel kann das Verfahren von LeBlanc Natriumsulfat durchgeführt wird, reduziert Kohlenstoff Sulfid. Dann ist es aus Kalziumsulfid erhalten wird, wird sie mit Kohlendioxid und Wasserdampf behandelt. Die sich ergebende Schwefelwasserstoff wird durch Luftsauerstoff in Gegenwart eines Katalysators oxidiert: 2H 2 S + O 2 = 2H 2 O + 2S. Bestimmung von Schwefel auf verschiedenen Wegen erhalten, gibt manchmal geringer Reinheit Indikatoren. Refining oder Reinigung durch Destillation, Rektifikation, Verarbeitung Mischungen von Säuren durchgeführt.

Die Verwendung von Schwefel in der modernen Industrie
Granular Schwefel geht zu den unterschiedlichen Produktionsanforderungen:
- Herstellung von Schwefelsäure in der chemischen Industrie.
- Produktion Sulfite und Sulfate.
- Lassen Sie die Vorbereitungen für Dünge Pflanzen, Krankheiten und Schädlinge.
- Schwefelhaltigen Erzen im Bergbau und chemischen Anlagen verarbeitet für NE-Metalle. Die gleichzeitige Produktion ist Schwefelsäure.
- Die Einführung einiger Stahlqualitäten besondere Eigenschaften zu verleihen.
- Durch Vulkanisieren Gummi erhalten Gummi.
- Produktion Streichhölzer, Pyrotechnik, Sprengstoffen.
- Verwendung zur Herstellung von Farben, Pigmente, synthetische Fasern.
- Bleichen von Textilien.
Die Toxizität von Schwefel und seine Verbindungen
Stäuben Teilchen einen unangenehmen Geruch, der Schleimhäute der Nasenhöhle und der Atemwege, der Augen und die Haut reizen. Aber elementarer Schwefel Toxizität ist nicht besonders hoch angesehen. Das Einatmen von Schwefelwasserstoff und Kohlendioxid kann zu schweren Vergiftungen führen.
Wenn Rösten schwefelhaltiger Erze in Schmelzöfen Abgase nicht eingeklemmt werden, treten sie in die Atmosphäre. Verbinden mit Tropfen und Wasserdampf, Schwefeloxide und Stickstoff entstehen die sogenannten sauren regen.
Schwefel und seine Verbindungen in der Landwirtschaft
Pflanzen verbrauchen Sulfationen zusammen mit der Bodenlösung. Reduzierung des Schwefelgehalts führt zu einer Verlangsamung in der grünen Zellen Stoffwechsel der Aminosäuren und Proteine. Daher Sulfate zur Düngung von landwirtschaftlichen Kulturen auf.

Geflügel Häuser, Keller, Gemüseläden einfache Substanz verbrannt oder behandelt mit modernen Einrichtungen Sulfonamide zu desinfizieren. Schwefeloxid besitzt antimikrobielle Eigenschaften, die lange Anwendung in der Herstellung von Wein gefunden haben, wenn Gemüse und Obst gelagert. Schwefel Medikamente werden als Schädlingsbekämpfungsmittel verwendet werden zur Behandlung von Krankheiten und Schädlinge (Echten Mehltau und Spinnmilben) zu steuern.
in der Medizin

Große Bedeutung für das Studium der medizinischen Eigenschaften des gelben Pulvers ergab große Ärzte der Antike Avicenna und Paracelsus. Es wurde später festgestellt, dass die Person nicht genug Schwefel aus der Nahrung schwächt bekommen, gesundheitliche Probleme auftreten (die Juckreiz und Schuppung der Haut, Haare und Nägel Schwächung enthalten). Tatsache ist, dass ohne Schwefel beeinträchtigte Synthese von Aminosäuren, Keratin, biochemischen Prozessen im Körper.
Medizinischer Schwefel für die Behandlung von Hautkrankheiten in die Salbe eingearbeitet: Akne, Ekzeme, Psoriasis, Allergie, Seborrhoe. Bäder mit Schwefel können die Schmerzen von Rheuma und Gicht lindern. Für eine bessere Absorption durch den Körper wasserlösliche Sulfonamide zu schaffen. Dies ist nicht ein gelbes Pulver, eine feinkristalline weiße Substanz. Für Außenanwendungen wird diese Verbindung in der kosmetischen Hautpflege verabreicht.
Gips ist seit langem in der Immobilisierung der verletzten Teile des Körpers verwendet. Glaubersalz wird als Abführmittel Medizin verschrieben. Magnesia senkt den Blutdruck, die bei der Behandlung von Bluthochdruck eingesetzt wird.
Schwefel in der Geschichte
Bereits in der Antike nicht-metallische Substanz gelbe Blüten ziehen die Aufmerksamkeit einer Person. Aber erst im Jahr 1789, fand der große Chemiker Lavoisier, dass das Pulver und Kristalle in der Natur gefunden, bestehend aus Schwefelatomen. Man glaubt, dass üblen Geruch bei seiner Verbrennung entstehen, alles Böse abstößt. Formel Schwefeloxid, das durch die Verbrennung erhalten wird, – SO 2 (Silica). Diese giftige Gase Inhalation ist es gefährlich für die Gesundheit. Mehrere Fälle von Massensterben ganzer Dörfer von Menschen an den Küsten, in den Niederungen der Wissenschaftler erklären die Zuteilung von Land oder Wasser Schwefelwasserstoff oder Schwefeldioxid.
Die Erfindung des Schießpulvers gesteigertes Interesse an dem gelben Kristalle durch das Militär. Viele Schlachten wurden aufgrund der Fähigkeit von Meister gewonnen Schwefel mit anderen Substanzen bei der Herstellung verbindet von Sprengstoffen. Die wichtigste Verbindung – Schwefelsäure – auch gelernt, wie man eine sehr lange Zeit zu verwenden. Im Mittelalter, es ist eine Substanz, Vitriolöl und Salz genannt – Sulfat. Kupfersulfat ist CuSO 4 und Eisensulfat FeSO 4 ist immer noch nicht ihre Bedeutung in der Industrie und in der Landwirtschaft verloren.