Lassen Sie uns darüber sprechen, wie die Art der Hybridisierung zu bestimmen
Lassen Sie uns darüber sprechen, wie die Art der Hybridisierung zu bestimmen, sowie betrachten die geometrische Struktur des Moleküls.
Die Geschichte des Begriffs
Im frühen zwanzigsten Jahrhundert L. Polinglom hat eine Theorie der Geometrie von Molekülen mit einer kovalenten Bindung vorgeschlagen. Als Basis, eine Verbindung zur Bildung wurde Überlappung von Elektronenwolken genommen. Das Verfahren wurde als Valenzbindungen bekannt. Wie die Art der Hybridisierung der Atome in Verbindungen bestimmen? Autor der Theorie vorgeschlagen Berücksichtigung der Mischung aus -Hybridorbitalen zu nehmen.
Definition
Um zu verstehen, wie die Art der Hybridisierung in den Verbindungen zu bestimmen, erklären wir, dass dieser Begriff bezieht.
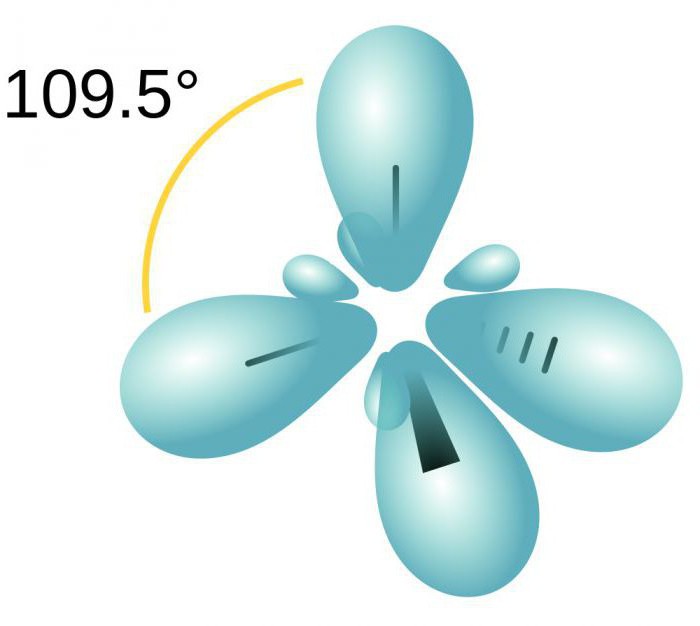
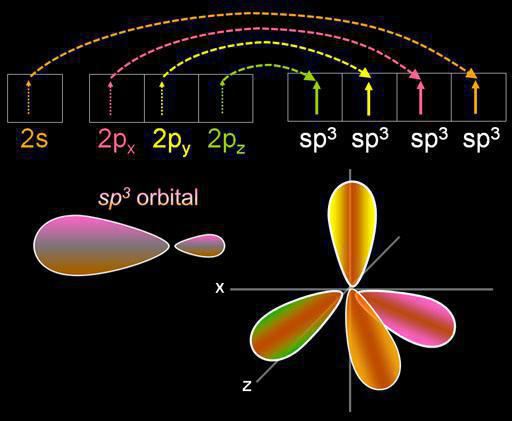
Hybridisierung ist die Vermischung der elektronischen Orbitale. Dieser Prozess wird durch die Verteilung der Energie in ihnen begleitet wird, verändern ihre Form. Je nachdem, wie viel wird s- und p-Orbitale gemischt wird, kann die Art der Hybridisierung variiert werden. Die organischen Verbindungen mit Kohlenstoff kann in einem Zustand, sp, sp2, sp3 existieren. Es gibt auch komplexere Formen beteiligt, zusätzlich zu sp, d-Orbitale.
Regeln für Moleküle Anorganika zu identifizieren
Die Hybridisierung kann Ausführungsform für Verbindungen mit einer kovalenten chemischen Bindung mit Typ AWP offenbart. A – basisches Atom, B – Ligand, n – Anzahl von zwei oder mehr. In einer ähnlichen Situation in der Hybridisierung nur die Valenzorbitale des Haupt Atom ein.
Verfahren zur Bestimmung
Wir werden mehr darüber sprechen, wie die Art der Hybridisierung zu bestimmen. In der chemischen Verständnis impliziert der Begriff Energiewende Formen und Orbitale. Es ist ein ähnlicher Prozess in jenen Fällen, in denen die Elektronen verwendet werden, die auf verschiedene Arten von Bindungsbildung gehören.
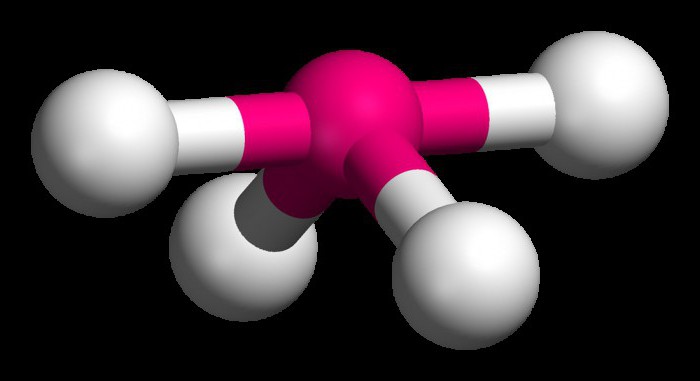
Um zu verstehen, wie die Art der Hybridisierung zu bestimmen, betrachten das Methanmolekül. Dieses Material ist das erste Mitglied der homologen Reihe der gesättigten (limit) Kohlenwasserstoffe. Im Raum des CH4-Moleküls ist Tetraeders. Einzelnes Kohlenstoffatom bildet eine Wasserstoffverbindung ähnliche Energie und Länge. Um ein solches Hybrid-Cloud zu bilden, gibt es drei P ES und ein Elektron.
Vier Wolken gemischt wird, und es gibt vier identische (hybrid) Typen mit unregelmäßiger Form acht. Wir nennen diese Art der Hybridisierung sp3. Alle Kohlenwasserstoffe in der Zusammensetzung, die nur einfach (single) Bindung, es durch diese Art der Hybridisierung von Kohlenstoffatom gekennzeichnet. Bindungswinkel beträgt 109 Grad 28 Minuten.
Wir werden weiterhin darüber sprechen, wie die Art der Hybridisierung zu bestimmen. Beispiele für den ungesättigten Kohlenwasserstoff der Ethylenreihe eine Vorstellung von sp2-Hybridisierung erhalten wurde . Zum Beispiel wird in einem Ethylen – Moleküle der vier Valenzelektronen ist nur drei in der Bildung von chemischen Bindungen verwendet. Die verbleibenden nicht-hybrid p-Elektron geht in die Bildung einer Doppelbindung.
Acetylene ist der einfachste Vertreter der Klasse SpN2p-2. Die Besonderheit dieser Klasse von Kohlenwasserstoffen ist das Vorhandensein einer Dreifachbindung. Von den vier Valenzelektronen des Kohlenstoffatoms nur zwei ihre Form und Energie ändern, hybrid werden. Die zwei verbleibenden Elektronen in der Bildung von zwei Doppelbindungen teilnehmen, ist die ungesättigte Natur dieser Klasse von organischen Verbindungen zu bestimmen.
Abschluss
Unter Berücksichtigung der Frage nach der kovalenten chemischen Bindung von organischen und anorganischen Substanzen, betrachten die Hybridisierung von Atomorbitalen. In diesem Fall ist es eine Ausrichtung ihrer Energie und Form. Electronic, in der Nähe des Kerns des Atoms gebunden ist , durch einen Satz von Orbitalen gekennzeichnet , dass identischen besitzen Quantenzahl. Informationen über die Art der Hybridisierung ermöglicht es, die chemischen Eigenschaften des Stoffes zu bewerten.












