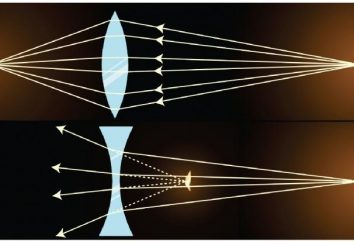
Heterogene Reaktionen – schlicht und einfach!
Viele Studenten beklagen, dass sie die Chemie nicht verstehen und es zu einem der schwierigsten Schulfächer zu berücksichtigen. Zum Beispiel legt nahe, ein Begriff „heterogene Reaktion“ Panik vieler Studenten. In gewisser Weise sind sie ohne Zweifel richtig. Doch mit der Chemie können und sollten Freunde sein. Es umgibt unser Leben überall. Die meisten guter Rat für Studenten, die bestimmt sind Freunde mit dieser schwierigen Wissenschaft zu machen – ein Lehrer ein bestimmtes Material für jede Lektion zu erteilen. Zur Vorbereitung für die Klassen nicht auf dem Prinzip: „Heute habe ich nicht fragen – dann kann man nicht lehren!“, Aber auf dem Prinzip: „Ich will wissen und verstehen alles, auch so erfahren, was ich habe nicht gefragt!“. Nur mit einem solchen Ansatz zur Business-Chemie wird für Sie ein offenes Buch sein. Und Sie werden verstehen und merken es in allen Aspekten unseres Lebens.
In diesem Artikel werden wir nur auf dieser chemischen Sache als heterogene Reaktion konzentrieren. Wie dieser Begriff zu verstehen? Wenn das Wort Reaktion ist mehr oder weniger klar (es auf die Wechselwirkung von Substanzen bezeichnet), hier mit dem Wort „heterogenen“ – in vielen Schulproblemen. Hier müssen wir die Übersetzung des griechischen Wortes „geteros“ erinnern – so unterschiedlich, vielfältig.
Heterogene Reaktion: Beispiele aus dem Leben
Heterogene Reaktionen zwischen den verschiedenen in der Natur nehmen, sondern der physische Zustand des Stoffes. Ein weitere der Grundschule jeder Schüler weiß, dass jede Substanz im Aggregatzustand sein kann, 3 (oder eine 3-Phasen) als Feststoff, eine Flüssigkeit oder einen gasförmigen Zustand. So ist es eine heterogene Reaktion in Betracht gezogen, wenn die Eingabe von Substanzen in sie, in verschiedenen Aggregatzuständen sind, zum Beispiel:
- Gas + Flüssigkeit
- Gas + solid
- Flüssigkeit + Feststoff.
Wenn die Substanzen, die miteinander reagieren, sind in dem gleichen Aggregatzustand, solche Reaktionen homogen genannt. Das Wort kann auch aus dem Griechischen „GOMOS“ übersetzt werden – das gleiche, ähnlich.
Homogene und heterogene Reaktionen treten häufig in unserem Leben. Betrachten wir zum Beispiel die Reaktion der Holzverbrennung. Brennholz – ist, im Großen und Ganzen eine chemische Substanz organischer Herkunft – Cellulose. Ohne Zweifel ist das Holz – eine Substanz, die in einem festen Zustand ist. Sie brennen durch die Einwirkung von Sauerstoff. Sauerstoff – ein Gas ist. Als Ergebnis die Verbrennungsreaktion gebildet von Brennholz Kohle, Kohlendioxid und Wasser. Die Verbrennung von Holz als Alkohol Brennen – eine heterogene Reaktion. Beispiele können bis ins Unendliche gebracht werden.
1) Rosten Eisen. Zuerst wird eine chemische Reaktion, da das Ergebnis der neuen Substanz ist aus Eisen gebildet – rust Eisenhydroxid (III). Zweitens ist es ein heterogenes Verfahren, da das Eisen – ist ein Feststoff und das Wasser und Luftsauerstoff, das unter dem Einfluß Rost kommt – ist Flüssigkeit und Gas ist. Dieser Prozess kann durch die folgende geschrieben werden Reaktionsgleichung :
Fe (tv.) + H 2 O (g.) + O2 (g) = Fe (OH) 3 (sol.)
2) Das Abschrecken von Essig Soda. Viele Mütter nutzen diese chemische Reaktion zur Herstellung von Teig üppig. Wenn dieser feste Soda NaHCO3 in Pulverform und eine 3% ige Lösung von Essigsäure CH3COOH genommen wird, ist es daher auch ein heterogenes Verfahren, da zwei zusammenwirkenden Substanzen in unterschiedlichen Aggregatzuständen. Dieser Prozess wird durch die Gleichung beschrieben:
NaHCO3 + CH3COOH = CH3COONa + H2O + CO2
Man beachte, dass hier, und die Reaktionsprodukte werden in verschiedenen Aggregatzuständen – Natriumacetat und Wasser CH3COONa + H2O – ist flüssig und CO2 – ist Kohlendioxid.
3) Schwärzung bronze Denkmäler oder Tafelsilber unter Umgebungsbedingungen – auch heterogene Reaktionen.
Ich hoffe, dass nun dieser Begriff nicht, dass Sie verursacht keine Probleme. Und wenn Sie noch Fragen haben, seien Sie nicht faul, ein Lehrbuch zu öffnen, auf Chemie für 8. Klasse und wiederholen Sie den wieder abgedeckt Material. Es schadet nie, es ist nicht umsonst, dass das russische Sprichwort sagt: „Repetition – Übung macht den“