Silizium und seine Verbindungen. Silizium in der Natur. Die Verwendung von Silizium
Eines der beliebtesten in der Kunst und Industrie von Elementen Silizium ist. Dass es verdankt seine ungewöhnlichen Eigenschaften. Heute gibt es viele verschiedene Verbindungen dieses Element, die eine wichtige Rolle bei der Synthese und Erstellung von technischen Produkten, Glaswaren, Glas, Ausrüstung, Baustoffe, Schmuck und anderen Branchen spielen.

Allgemeine Eigenschaften von Silizium
Wenn wir die Position von Silizium im Periodensystem betrachten, ist es möglich, zu sagen:
- IV wird in den wichtigsten Untergruppen der Gruppe befindet.
- Die Sequenznummer 14.
- Atommasse 28,086.
- Das chemische Symbol Si.
- Name – Silizium oder in Latein – silicium.
- Die elektronische Konfiguration der Außenschicht 4e: 2e: 8e.
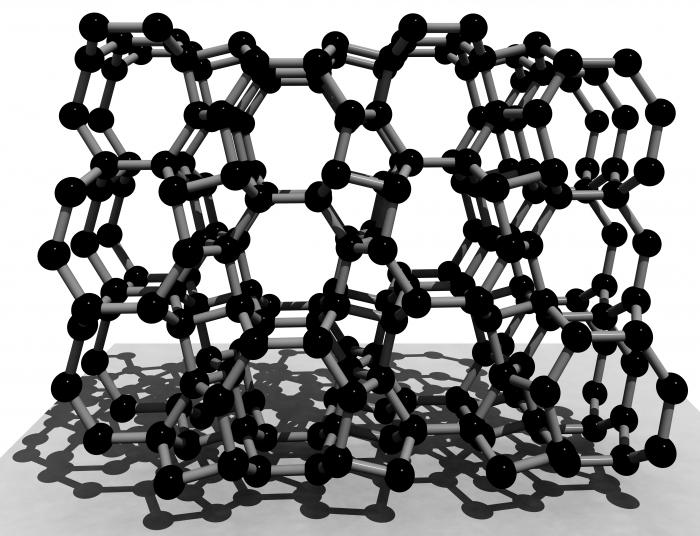
Das Kristallgitter des Siliziums ist ähnlich das Diamantgitter. Die Knoten sind so angeordnet Atomen, dessen Typ – eine flächenzentrierte kubische. Jedoch aufgrund der größeren Länge der Kommunikations physikalischen Eigenschaften des Siliciums unterscheiden sich stark von den Eigenschaften der Kohlenstoff allotropen Modifikation.
Physikalische und chemische Eigenschaften
Es gibt zwei allotrope Modifikation des Elements: amorph und Kristall. Sie sind sehr ähnlich. Jedoch, wie es der Fall mit anderen Materialien, der Hauptunterschied zwischen ihnen – die kristallinen Siliciumgitter.
In diesem Fall sind beide Versionen – ein Pulver aus verschiedenen Farben.
1. Kristallines Silizium ist ein glänzendes dunkelgrau pulverartigen Metall. Seine Struktur entspricht Diamanten, aber unterschiedliche Eigenschaften. Es verfügt über:
- Zerbrechlichkeit;
- geringe Härte;
- Halbleitereigenschaften;
- Die Schmelztemperatur von 1415 0 C;
- Dichte 2,33 g / cm 3;
- die Siedetemperatur von 2700 0 C.
Seine chemische Aktivität ist gering im Vergleich zu anderer allotrope Form.
2. Amorphes Silizium – braun braunes Pulver, hat die Struktur silnorazuporyadochennogo Diamanten. Reaktivität ist hoch genug.
Generell sollte darauf hingewiesen werden, dass Silizium gefällt nicht reagieren. Um es zu reagieren, notwendige Temperatur nicht weniger als 400-500 0 C. Verschiedene chemische Verbindungen aus Silizium unter diesen Bedingungen gebildet. Sowie:
- Oxide;
- Halide;
- Selbstmord begangen haben;
- Nitride;
- Boride;
- Carbide.
Vielleicht ist die Wechselwirkung von Silizium mit Salpetersäure oder einem Alkali, die ein Ätzprozeß bezeichnet wird. Die weit verbreitete Silikone, die jetzt immer häufiger werden.
in der Natur
Silizium wird natürlich in einem ganz erheblichen Menge gefunden. Es ist an zweiter Stelle nach Sauerstoff-Prävalenz. Sein Gewichtsanteil beträgt ca. 30%. Meerwasser enthält auch ein aktives Element in einer Konzentration von 3 mg / L. Deshalb können wir sagen, dass Silizium in der Natur nicht – es ist ein seltenes Element ist.
Im Gegenteil, es gibt viele verschiedenen Gesteine und Mineralien, in dessen Rahmen sie und aus der auftritt, kann sie extrahiert werden. Die häufigsten natürlichen Siliciumverbindungen sind:
- Silica. Die chemische Formel SiO 2. Es gibt durchaus eine Vielzahl von Formen der Mineralien und Gesteine auf der Basis: Sand, Kies, Feldspat, Quarz, Bergkristall, Amethyst, Chalzedon, Karneol, Opal, Jaspis und andere.
- Silikate und Aluminiumsilikate. Kaolin, Feldspat, Glimmer, Kieselsäure Salz, Asbest, Talk.
Somit sind die Verbreitung in der Natur weit Silizium und seine Verbindungen beliebt und die Nachfrage nach Menschen für technische Zwecke zu verwenden.

Silizium und seine Verbindungen
Da reines Element existieren betrachtet kann daher nicht haben, unterschiedliche Bedeutung seiner Verbindungen. Vom chemischen Standpunkt aus kann es drei Oxidationszustand +2, +4, seine -4. Hiervon ausgehend, und auch wegen ihrer Trägheit, sondern vor allem an der kristallinen Gitterstruktur, erzeugt es die folgenden Arten von Substanzen:
- binäre Verbindungen mit Nichtmetallen (Silan, Karbid, Nitrid, Phosphid, und so weiter;
- Oxide;
- Kieselsäure;
- Metallsilikaten.
Betrachten wir, wie wichtig das Silizium und seine Verbindungen, für Menschen, die am häufigsten und beliebt sind.

Siliziumoxide
Es gibt zwei Arten von durch die Formel Substanzen:
- SiO;
- SiO 2.
Allerdings sind die am häufigsten verwendet dioxid. Es existiert in der Natur in Form eines sehr schönen Halbedelsteine:
- Achat;
- Chalzedon;
- Opal;
- Karneol;
- Jaspis;
- Amethyst;
- Bergkristall.
Die Verwendung von Silizium in dieser Form hat ihre Anwendung in der Herstellung von Schmuck gefunden. Unglaublich schöne Gold- und Silberschmuck mit diesem Halbedel und machten Halbedelsteine.
Einige Variationen des Silica:
- Quarz;
- Fluss und Quarzsand ;
- Feuerstein;
- Feldspat.
Die Verwendung von Silizium in solchen Typen implementiert in Bau, Maschinenbau, Elektronik, chemische Industrie, Metallurgie. Zusammen beziehen sich die genannten Oxide auf einen einzelnen Stoff – Kieselsäure.
Karbid Kremniya und seine Verwendung
Silizium und seine Verbindungen – ein Werkstoff der Zukunft und die Gegenwart. Ein solches Material ist Siliciumcarbid oder Carbid des Elements. Die chemische Formel von SiC. Es kommt in der Natur als das Mineral moissanite.
In reiner Form aus Kohlenstoff und Silicium-Verbindung – ist schön, transparente Kristalle, diamantartiger Struktur. Doch für technische Zwecke in grün und schwarz Farbmaterial gemalt.
Wichtigste Eigenschaften des Stoffes, die den Einsatz in Industrie, Technik, chemische Industrie, die folgenden:
- Halbleiter mit großer Bandlücke;
- sehr hohe Festigkeit (7 Mohs) ;
- beständig gegen hohe Temperaturen;
- ausgezeichnete elektroustoychivost und thermische Leitfähigkeit.
All dies ermöglicht die Verwendung von Siliciumcarbid als Schleifmaterial in der Metallurgie und der chemischen Synthese. Auch ist es auf Basis LEDs erzeugt ein breites Wirkungsspektrum, um Teile des Glasofen, Düsen, Brenner, Schmuck (Moissanit geschätzt FIANITE oben).

Silane und ihre Bedeutung
Wasserstoffsiliciumverbindung Silan und der Name nicht durch direkte Synthese aus Ausgangsmaterialien erhalten werden. Zu erhalten, um die verschiedenen Metallsilizide verwendet werden, die einer Säurebehandlung unterzogen werden. Als Ergebnis wird das Silan Gas freigesetzt und bildet ein Metallsalz.
Es ist interessant, dass die Verbindung in Frage nie allein produziert. Immer in der Umsetzung eines Gemisches von Mono-, Di- und Trisilan in denen Siliciumatome miteinander in Ketten verbunden.
Auf den Eigenschaften dieser Verbindungen – starke Reduktionsmittel. Sich so leicht durch Sauerstoff oxidiert, manchmal explosiv. Heftige Reaktion mit Halogenen immer mit viel Energie freigesetzt.
Die Anwendung der folgenden Silane:
- Reaktionen der organischen Synthese, als Ergebnis der es wichtig ist, Silikone – Silikon, Gummi, Dichtungsmitteln, Schmiermitteln, Emulsionen und andere.
- Mikroelektronik (LCD-Monitore, integrierte technische Diagramme, etc.).
- Hohe Reinheit Polysilizium.
- Zahnprothetik.
Somit ist die Silane in der modernen Welt hoch.

Kieselsäure und Silikate
Hydroxid des Elements – sie sind verschiedene Kieselsäuren. unterschieden:
- meta;
- o;
- Polysilizium und andere Säuren.
Alle von ihnen haben gemeinsame Merkmale – das extreme Ungleichgewicht im freien Zustand. Sie werden leicht durch Wärme zerlegt. Unter normalen Bedingungen gibt es kurzlebig, zuerst in ein Sol drehen und dann einem Gel. Nach dem Trocknen werden die Kieselgele, solche Strukturen genannt. Sie werden als Adsorbentien in Filtern verwendet.
Wichtig aus der Sicht der Industrie, sind die Salze von Kieselsäuren – Silikate. Sie sind die Grundlage der Herstellung solcher Substanzen, wie zum Beispiel:
- Glas;
- Beton;
- Zement;
- Zeolith;
- Kaolin;
- Porzellan;
- Steingut;
- Kristall;
- Keramik.
Alkalimetallsilicate – löslich, der Rest – Nr. Daher wird das Natrium- und Kaliumsilikatwasserglas bezeichnet. Normal-Briefpapier Klebstoff – dies ist das Natriumsalz der Kieselsäure.
Aber die interessantesten Verbindungen sind alle aus dem gleichen Glas. Welche Optionen nur für diesen Stoff keine Ahnung! Heute, da farbige, optisch, matte Optionen. Gläser in ihrer Pracht und Vielfalt verblüffend. Wenn die Zugabe bestimmte Metall- und Nichtmetalloxide zu dem Gemisch kann eine Vielzahl von Arten von Glas erhalten. Manchmal sogar die gleiche Zusammensetzung, aber unterschiedliche Prozentsätze der Komponenten führt zu einem Unterschied in den Eigenschaften des Stoffes. Beispiele sind Porzellan und Steingut, die Formel SiO 2 · Al 2 O 3 · K 2 O.
Quarzglas – ist eine Form von hochreines Produkt, dessen Zusammensetzung wie Siliciumdioxid beschrieben.

in den Siliciumverbindungen Entdeckung
In den letzten Jahren haben Studien zeigen, dass Silizium und seine Verbindungen gezeigt – die wichtigsten Teilnehmer im Normalzustand lebenden Organismen. C-Mangel oder Überschuss an einem gegebenen Element assoziierten Krankheiten wie:
- Krebs;
- Tuberkulose;
- Arthritis;
- Katarakt;
- Lepra;
- Ruhr;
- Rheuma;
- Hepatitis und andere.
Alterungsprozesse selbst sind auch mit dem quantitativen Gehalt an Silizium verbunden. Zahlreiche Versuche an Säugetieren haben gezeigt, dass das Fehlen eines Elements mit Herzinfarkt, Schlaganfall, Krebs und Hepatitis-C-Virus aktiviert wird.