Elektrolyte: Beispiele. Die Zusammensetzung und die Eigenschaften von Elektrolyten. Starke und schwache Elektrolyte
Elektrolyte sind die seit der Antike bekannt Chemikalien. Allerdings sind die meisten Bereiche ihrer Anwendung, sie haben vor kurzem gewonnen. Wir werden die oberste Priorität für die Industrie, um die Verwendung dieser Stoffe diskutieren und wir werden verstehen, dass die Vergangenheit die Gegenwart ist, und sich voneinander unterscheiden. Aber wir beginnen mit einem Exkurs in die Geschichte.

Geschichte
Die ältesten bekannten Elektrolyten – Salze und Säuren ist offen, auch in der alten Welt. Allerdings hat das Verständnis der Struktur und die Eigenschaften von Elektrolyten im Laufe der Zeit weiterentwickelt. Theorie diese Prozesse haben sich seit 1880 entwickelt hat, als er eine Reihe von Entdeckungen gemacht wurde, Theorien auf die Eigenschaften des Elektrolyten bezogen. Es gab mehrere Quantensprünge in Theorien beschreiben die Mechanismen der Interaktion der Elektrolyten mit Wasser (in der Tat nur in Lösung sie die Eigenschaften erwerben, die ihre Verwendung in der Industrie zu machen).
Jetzt werden wir genau sehen, sind mehrere Theorien, die den größten Einfluss auf die Entwicklung von Konzepten von Elektrolyten und deren Eigenschaften gehabt haben. Lassen Sie uns mit den häufigsten und einfache Theorie beginnen, dass jeder von uns in der Schule nahm.
Arrhenius Theorie der elektrolytischen Dissoziation
Im Jahre 1887 der schwedische Chemiker Svante Arrhenius und russisch-deutschen Chemiker entwickelte Wilhelm Ostwald die Theorie der elektrolytischen Dissoziation. Aber auch hier ist es nicht so einfach. Arrhenius selbst war Fan sogenannter physikalische Theorie der Lösungen, die mit Wasser nicht das Zusammenspiel der Komponenten des Stoffes berücksichtigen und behauptete, dass es frei geladenes Teilchen (Ionen) in Lösung ist. By the way, aus solchen Positionen betrachten heute die elektrolytische Dissoziation der Schule.
Wir sprechen alle gleich, dass die Theorie macht und wie es erklärt den Mechanismus der Wechselwirkung von Substanzen mit Wasser. Wie bei jedem anderen Job, hat es mehrere Postulate, die es verwendet:
1. Bei der Reaktion von Wasser mit der Substanz zerfällt in Ionen (positive – und negativen Kation – Anion). Diese Partikel werden an Hydratation unterzogen, sie Wassermoleküle anziehen die übrigens auf der einen Seite positiv geladen ist und auf der anderen – negativen (Dipol gebildet wird) in Aqua-Komplexe (Solvate) zu bilden.
2. Der Dissoziation Vorgang ist reversibel – das heißt, wenn der Stoff in Ionen aufgespalten wird, unter dem Einfluss von jedem Faktor, es wieder eine Quelle werden kann.
3. Wenn die Verbindungselektroden zu der Lösung und den Strom lassen, werden die Kationen beginnen mit der negativen Elektrode zu bewegen – die Kathode und Anionen zum positiv geladenen – Anode. Deshalb sind die Substanzen, die in Wasser leicht löslich sind, leiten Strom besser als das Wasser selbst. Aus dem gleichen Grund werden sie Elektrolyte genannt.
4. Der Grad der Dissoziation des Elektrolyten charakterisiert prozentuale Substanz zur Auflösung unterzogen. Diese Rate hängt von dem Lösungsmittel und den Eigenschaften des gelösten Stoffs, die Konzentration des letzteren und die Außentemperatur.
Hier, in der Tat, und alle grundlegenden Lehren dieser einfachen Theorie. Sie werden wir in diesem Artikel für eine Beschreibung verwenden, was in der Elektrolytlösung geschieht. Beispiele für diese Verbindungen Lassen Sie uns ein wenig später untersuchen, und lassen Sie uns jetzt eine andere Theorie betrachten.

Theorie Säuren und Lewis-Basen
Nach der Theorie der elektrolytischen Dissoziation, Säure – eine Substanz, die in einer Lösung, deren Wasserstoffkation und Base – Verbindung zersetzt sich in Lösung auf ein Hydroxidanion. Es gibt eine andere Theorie, benannt nach dem berühmten Chemiker Gilbert Lewis. Es ermöglicht Ihnen das Konzept von mehreren Säuren und Basen zu erweitern. Gemäß der Lewis – Theorie, die Säure – ist , die Ionen oder Moleküle von Substanzen, die ein Elektron von einem anderen Molekül freie Elektronenorbitale und der Lage sind , haben zu akzeptieren. Leicht zu erraten, dass die Basen werden jene Partikel sein, die fähig sind, ein oder mehrere seiner Elektronen zu geben, um „Verwendung“ Säure. Es ist hier interessant ist, dass Säure oder Base sein kann, nicht nur der Elektrolyt, sondern auch jede Substanz, die auch in Wasser unlöslich.

Protolytische Theorie Brendsteda Lowry
Im Jahr 1923 unabhängig voneinander zwei Wissenschaftler – J. und T. Lowry Bronsted -predlozhili Theorie, die jetzt aktiv von den Wissenschaftlern verwendet wird, um die chemischen Prozesse zu beschreiben. Das Wesen dieser Theorie ist, dass die Dissoziation der Bedeutung von der Säure-Base zu einem Protonentransfer kommt nach unten. Somit wird dieser hier als Protonenakzeptor verstanden. Dann ist die Säure ihr Donator. Die Theorie erklärt auch die Existenz von guten Substanzen, die Eigenschaften und Säuren und Basen aufweisen. Solche Verbindungen sind amphotere genannt. In der Theorie Brönsted-Lowry für ihren Begriff gilt auch Ampholyte, während Säure oder Base, die üblicherweise genannt Protolithe.
Wir haben in den nächsten Abschnitt kommen. Hier werden wir Ihnen, was andere starke und schwache Elektrolyte zeigen und diskutieren die Auswirkungen externer Faktoren auf ihre Eigenschaften. Und dann auf die Beschreibung ihrer praktischen Anwendung zu gehen.
Starke und schwache Elektrolyte
Jede Substanz reagiert mit Wasser allein. Einige auflösen gut (zB Natriumchlorid), und einige nicht lösen (zB Kreide). Somit werden alle Substanzen in starke und schwache Elektrolyte aufgeteilt. Letztere sind Substanzen, die auf der Unterseite der Lösung schlecht mit Wasser und abgeschieden in Wechselwirkung treten. Dies bedeutet, dass sie einen sehr niedrigen Grad der Dissoziation und die hohen Energiebindungen aufweisen, die das Molekül in seine Komponentenionen unter normalen Bedingungen zersetzen kann. Dissociation schwachen Elektrolyten erfolgt entweder langsam oder durch Erhöhung der Temperatur und der Konzentration der Substanz in Lösung.
Sprechen Sie über einen starken Elektrolyten. Dazu gehören alle löslichen Salze, sowie starke Säuren und Laugen. Sie sind leicht in Ionen zu brechen und ist sehr schwierig, sie in Niederschläge zu sammeln. Der Strom in dem Elektrolyten, nebenbei bemerkt, wird dank der in der Lösung enthaltenen Ionen durchgeführt. Daher ist das beste leitende starke Elektrolyte. Beispiele für letztere: starke Säuren, Laugen, lösliches Salz.
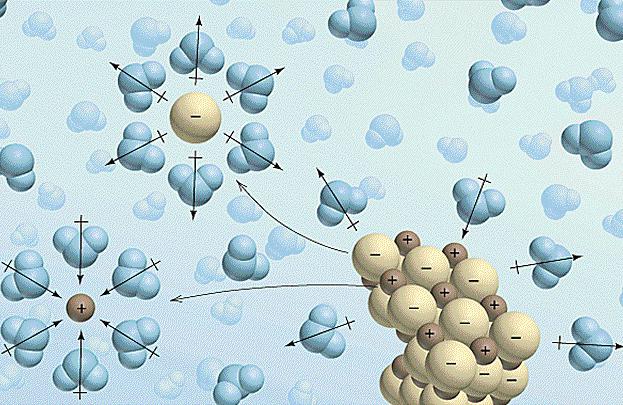
Faktoren das Verhalten von Elektrolyten zu beeinflussen
Betrachten wir nun , wie sich die Änderung auf die die äußere Umgebung beeinflusst Eigenschaften von Stoffen. Die Konzentration wirkt sich direkt auf den Grad der Dissoziation des Elektrolyten. Darüber hinaus kann diese Beziehung mathematisch ausgedrückt werden. Das Gesetz , das diese Beziehung beschreibt, genannt das Gesetz der Verdünnung von Ostwald und wird wie folgt geschrieben: a = (K / C) 1/2. Hier wird ein – ist der Grad der Dissoziation (als Fraktion genommen), K – Dissoziationskonstante, unterschiedlich für jeden Stoff, und mit – der Elektrolytkonzentration in der Lösung. Nach dieser Formel kann man viel über die Materie und sein Verhalten in Lösung erfahren.
Aber wir haben aus dem Thema abgekommen. Eine weitere Konzentration nach dem Grad der Dissoziation des Elektrolyten beeinflußt auch die Temperatur. Für die meisten Substanzen erhöhen sie die Löslichkeit und Reaktivität erhöht. Dies kann das Auftreten bestimmter Reaktionen nur bei erhöhter Temperatur erklären. Unter normalen Bedingungen sind sie entweder sehr langsam oder in beiden Richtungen (Dieser Vorgang ist reversibel genannt).
Wir haben die Faktoren untersucht, die das Verhalten eines Systems, wie beispielsweise einer Elektrolytlösung bestimmen. Jetzt bewegen wir uns auf die praktische Anwendung dieser auf, ohne Zweifel sehr wichtig, chemische Substanzen.
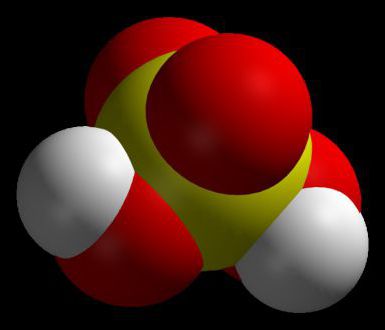
industrielle Anwendung
Natürlich hat jeder das Wort „Elektrolyt“ gehört zu den Batterien angewendet. In einem Fahrzeug, Blei-Säure-Batterien verwendet wird, der Elektrolyt, in dem übernimmt die Rolle eines 40-prozentigen Schwefelsäure. Um zu verstehen, warum es ist alles, was Sie brauchen, ist ein Stoff notwendig ist, die Eigenschaften der Batterie zu verstehen.
Also, was ist das Prinzip des Betriebes jeder Batterie? In der reversiblen Reaktion, die die Umwandlung eines Stoffes in einem anderen stattfindet, als Ergebnis der die Elektronen freigesetzt werden. Wenn die Batterieladung Wechselwirkung tritt Substanzen, die unter normalen Bedingungen nicht möglich ist. Dies kann als die Anhäufung von Macht in dem Material, das als Ergebnis einer chemischen Reaktion dargestellt werden. Wenn beginnt die Rücktransformation entladen, um das System in seinen ursprünglichen Zustand zu reduzieren. Diese beiden Prozesse bilden zusammen eine Lade-Entlade-Zyklus.
das vorstehende Verfahren prüft, ist ein konkretes Beispiel – die Blei-Säure-Batterie. Da es leicht zu erraten ist, besteht die Stromquelle aus einem Element, einen Vorsprung (diokisd Blei und PbO 2) und eine Säure umfaßt. Jede Batterie besteht aus den Elektroden und den Raum zwischen ihnen nur mit dem Elektrolyten gefüllt. Wie letztere, wie wir in diesem Beispiel gesehen haben, verwendet Schwefelsäurekonzentration von 40 Prozent. Die Kathode der Batterie aus Bleidioxid hat, wird die Anode aus reinem Blei. All dies ist, weil diese beiden verschiedenen Elektroden reversible Reaktionen, die auftreten, die Ionen dissoziierten Säure sind:
- PbO 2 + SO 4 2- + 4 H + + 2e – = PbSO 4 + 2H 2 O (die Reaktion an der negativen Elektrode auftritt – Kathode).
- Pb + SO 4 2- – 2e – = PbSO 4 (die Reaktion an der positiven Elektrode auftritt , – die Anode).
Wenn Sie die Reaktion lesen von links nach rechts – die Prozesse erhalten während der Batterieentladung auftritt, und wenn sie nach rechts – gegen Gebühr. Jede chemische Stromquelle dieser Reaktionen ist anders, aber der Mechanismus ihres Auftretens im Allgemeinen beschreibt die gleiche: Es gibt zwei Verfahren, von denen Elektronen „absorbiert“ werden und die andere umgekehrt „ gehen.“ Das Wichtigste ist, dass die Zahl der absorbierten Elektronen gleich der Anzahl veröffentlicht.
Eigentlich neben Batterien gibt es viele Anwendungen dieser Stoffe. Im Allgemeinen Elektrolyte, von denen Beispielen uns gegeben haben, – es ist nur ein Körnchen der Vielzahl von Substanzen, die unter diesem Begriff vereint sind. Sie umgeben uns überall, überall. Zum Beispiel der menschliche Körper. Glauben Sie, es gibt keine solche Substanzen? Sehr falsch. Sie sind überall in uns und bilden die größte Anzahl von Blutelektrolyten gefunden. Hierzu gehören beispielsweise Eisenionen, die einen Teil des Hämoglobins sind und hilft, transportieren Sauerstoff zu den Geweben des Körpers. Blutelektrolyte auch eine Schlüsselrolle bei der Regulierung des Wasser-Salz-Gleichgewichts und der Arbeit des Herzens spielen. Diese Funktion wird durch Kaliumionen und Natriumdurchgeführt (es ist auch ein Prozess, der in den Zellen auftritt, die Kalium-Natrium-Pumpe genannt werden).
Jede Substanz, die Sie in der Lage sind zu lösen zumindest ein wenig – Elektrolyte. Und es gibt keine Industrie und unser Leben, wo immer sie angewandt werden. Es ist nicht nur die Batterien in Autos und Batterien. Sind jede chemische und Lebensmittel-Verarbeitung, militärische Fabriken, Kleidungsstück Fabriken und so weiter.
Die Elektrolytzusammensetzung, nebenbei gesagt, ist anders. Somit ist es möglich, die sauren und alkalischen Elektrolyten bereitzustellen. Sie unterscheiden sich grundlegend in ihren Eigenschaften: wie wir gesagt haben, Säuren sind Protonenspender und Alkali – Akzeptoren. Aber im Laufe der Zeit, die Elektrolytzusammensetzung ändert aufgrund des Verlustes eines Teils der Stoffkonzentration entweder abnimmt oder zunimmt (es hängt alles davon ab, was verloren geht, Wasser oder Elektrolyten).
Jeden Tag werden wir mit ihnen konfrontiert, aber nur sehr wenige Menschen wissen genau die Definition eines solchen Begriff als Elektrolyte. Beispiele für spezifische Substanzen, die wir diskutierten, so kommen sich zu etwas komplexen Konzepten bewegen.

Die physikalischen Eigenschaften von Elektrolyten
Jetzt über Physik. Das Wichtigste in der Studie zu diesem Thema zu verstehen – der Strom zu den Elektrolyten geleitet wird. Entscheidende Rolle in dieser durch die Ionen gespielt. Diese geladenen Teilchen können von einem Teil der Ladungslösung zum anderen wandern. So Anionen neigt dazu, immer mit der positiven Elektrode und Kationen – zum negativen. Somit wird durch auf den elektrischen Strom wirkt, Lösung, teilen wir die Ladungen auf entgegengesetzten Seiten des Systems.
Sehr interessante physikalische Eigenschaften wie Dichte. Es wirkt sich auf viele Eigenschaften unserer Verbindungen diskutiert. Und oft erscheint die Frage: „Wie die Dichte des Elektrolyten zu erhöhen“ In der Tat ist die Antwort einfach: es ist notwendig, um den Wassergehalt der Lösung zu senken. Da die Dichte des Elektrolyten , der hauptsächlich bestimmt Dichte der Schwefelsäure, es hängt weitgehend von der Endkonzentration. Es gibt zwei Möglichkeiten, den Plan umzusetzen. Die erste ist ganz einfach: der Elektrolyt in der Batterie enthaltenen kochen. Um dies zu tun, müssen Sie ihn laden, so dass die Innentemperatur über einhundert Grad Celsius leicht gestiegen. Wenn diese Methode nicht funktioniert, keine Sorge, es eine andere ist: einfach den alten neuen Elektrolyten ersetzen. Um dies zu tun, abtropfen läßt die alte Lösung, die die Innenseite der restlichen Schwefelsäure in destilliertem Wasser zu reinigen, und dann einen neuen Teil gießen. Typischerweise wird die Qualität der Elektrolytlösungen hat unmittelbar einen gewünschten Konzentrationswert. Nach dem Austausch kann über vergessen, wie die Dichte des Elektrolyten zu erhöhen.
Die Elektrolytzusammensetzung bestimmt weitgehend dessen Eigenschaften. Eigenschaften wie elektrische Leitfähigkeit und Dichte, beispielsweise hängen stark von der Natur des gelösten Stoffes und seiner Konzentration. Es gibt eine separate Frage, wie viel des Elektrolyten in der Batterie sein kann. In der Tat ist sein Volumen auf die ausgewiesenen Kapazität des Produktes in direktem Zusammenhang. Je mehr Schwefelsäure im Inneren der Batterie, so dass es stärker ist, t. E. Je mehr Spannung erzeugen kann.

Wo ist es sinnvoll?
Wenn Sie ein Auto-Enthusiasten oder einfach nur interessiert sich für Autos sind, werden Sie alles selbst verstehen. Sicher wissen Sie auch, wie Sie feststellen, wie viel Elektrolyt in der Batterie jetzt ist. Und wenn Sie aus dem Auto unterwegs sind, dann ist die Kenntnis der Eigenschaften dieser Stoffe, deren Verwendung und wie sie miteinander interagieren nicht überflüssig sein. Wenn man das weiß, du bist nicht verwirrt, sagen Sie werden gebeten, was der Elektrolyt in der Batterie. Obwohl auch wenn Sie nicht ein Auto-Liebhaber sind, aber Sie ein Auto haben, dann wird das Wissen der Batterievorrichtung absolut keinen Schaden an und helfen Ihnen, zu reparieren. Es wird viel einfacher und billiger zu dir selbst alles zu tun, als auf das Auto-Center zu gehen.
Und um mehr über dieses Thema zu erfahren, empfehlen wir, dass Sie das Lehrbuch der Chemie Besuche für Schulen und Universitäten. Wenn Sie diese Wissenschaft gut kennen und genug Bücher lesen, die beste Option ist „Chemische Stromquellen“ Varypaeva. Es gibt im Detail die ganze Theorie der Akkulaufzeit, eine Vielzahl von Batterien und Wasserstoff Elemente enthalten.
Abschluss
Wir haben zu einem Ende kommen. Lassen Sie uns zusammenfassen. Oben haben wir alles besprochen, wie es so etwas wie Elektrolyte: Beispiele, Strukturtheorie und die Eigenschaften, Funktionen und Anwendungen. Wieder einmal ist zu sagen, dass diese Verbindungen ein Teil unseres Lebens sind, ohne welche es nicht, unser Körper und allen Bereichen der Industrie existieren. Erinnern Sie sich an die Blutelektrolyte? Dank ihnen wir leben. Und was ist mit unseren Autos? Mit diesem Wissen können wir jedes Problem mit der Batterie beheben, wie jetzt verstehen, wie die Dichte des Elektrolyten darin zu erhöhen.
Alle unmöglich zu sagen, aber wir haben nicht so ein Ziel gesetzt. Schließlich ist es nicht alles, was über diese erstaunlichen Substanzen erzählt werden kann.