Was ist Kohlenmonoxid? molecular structure
Kohlenmonoxid, das auch als Kohlenmonoxid bekannt, eine sehr starke molekulare Struktur aufweist, ist inert gegenüber den chemischen Eigenschaften und ist schlecht in Wasser löslich. Diese Verbindung ist auch extrem toxisch, wenn sie in das Atmungssystem freigesetzt wird, auf die Blut-Hämoglobin verbunden ist, und dass nicht mehr Übertragungs Sauerstoff zu Geweben und Organen.
Chemische Bezeichnung und Formel
Kohlenmonoxid wird auch unter anderen Namen bekannt, einschließlich Kohlenmonoxid II. Im Alltag ist es in der Regel Kohlenmonoxid genannt. Das Kohlenmonoxid ist ein giftiges Gas, farb- und geschmacksneutral, geruchlos. Seine chemische Formel – CO, und die Masse eines einzelnen Moleküls beträgt 28,01 g / mol.

Auswirkungen auf dem Körper
Kohlenmonoxid-Hämoglobin bindet an Carboxyhämoglobin zu bilden, der Sauerstoff nicht Tragfähigkeit. Inhalation von Dampf verursacht ZNS-Schädigung (Zentralnervensystem), und Erstickung. Der daraus resultierende Mangel an Sauerstoff verursacht Kopfschmerzen, Schwindel, Herzfrequenz verringert und die Atemfrequenz, was zu Bewusstlosigkeit und anschließenden Tod des Organismus.

giftiges Gas
Kohlenmonoxid wird durch teilweise Verbrennung von kohlenstoffhaltigen Substanzen, wie beispielsweise in Verbrennungsmotoren erzeugt werden. Die Verbindung 1 enthält ein Kohlenstoffatom kovalent an ein Sauerstoffatom gebunden ist. Kohlenmonoxid ist hochgiftig, und es ist eine der häufigsten Ursachen für tödliche Vergiftungen weltweit. Exposition kann zu Herzschäden und anderen Organen führen.
Was ist die Verwendung von Kohlenmonoxid?
Trotz seiner schweren Toxizität ist Kohlenmonoxid extrem nützlich – dank der modernen Technik der es eine ganze Reihe von lebenswichtigen Produkte zu schaffen. Kohlenmonoxid obwohl heute als eine Verunreinigung in der Natur immer vorhanden, aber nicht in einer Menge, wie beispielsweise Kohlendioxid.
Mistaken sind diejenigen, die glauben, dass es keine Verbindung von Kohlenmonoxid in der Natur. CO in dem geschmolzenen vulkanischen Gestein bei hohen Drücken in Erdmantel gelöst. Der Gehalt an Kohlenstoffoxiden in vulkanischen Gasen variiert von weniger als 0,01% auf 2%, abhängig von dem Vulkan. Da natürliche diese Verbindung kein konstanter Wert ist, um genau die Erdgas-Emissionen zu messen, ist nicht möglich.

chemische Eigenschaften
Kohlenmonoxid (CO Formel) bezieht oder indifferent Oxide zu. Jedoch bei einer Temperatur von +200 o C reagiert es mit Natriumhydroxid. Während dieser chemischen Verfahren ist die Bildung von Natriumformiat:
NaOH + CO = HCOONa (Ameisensäure-Salz).
Eigenschaften von Kohlenmonoxid auf der Grundlage ihrer Belastbarkeit. Kohlenmonoxid:
- mit Sauerstoff zur Reaktion gebracht werden: 2CO + O 2 = 2CO 2;
- fähig ist , mit Halogenen reagieren: CO + Cl 2 = COCl 2 (Phosgen);
- Es hat die einzigartige Eigenschaft , sich zu erholen reinen Metallen aus ihren Oxiden: Fe 2 O 3 + 3CO = 2Fe + 3CO 2;
- Bilden Metallcarbonyle: Fe + 5CO = Fe (CO ) 5;
- vollkommen löslich in Chloroform, Essigsäure, Ethanol, Benzol und Ammoniumhydroxid.
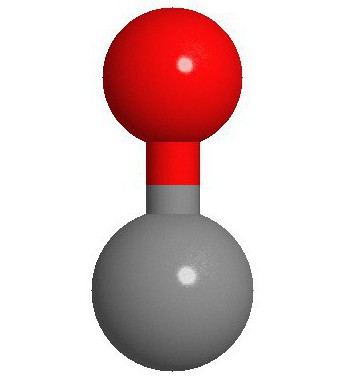
Die Struktur des Moleküls
Zwei Atome von denen in der Tat ist ein Molekül, von Kohlenmonoxid (CO), verbunden Dreifachbindung. Dank des speziellen Mechanismus durch freies Kohlenstoff 2P-Orbital und die 2P-Elektronen-Paare von Sauerstoff – zwei von ihnen werden durch die Zusammenlegung p-Elektronen der Kohlenstoffatom mit Sauerstoff, und die dritte gebildet. Diese Struktur stellt ein Molekül mit hoher Festigkeit.
Ein wenig Geschichte
Aristoteles des antiken Griechenland beschrieben die giftigen Dämpfe durch die Verbrennung von Kohle erzeugt. Der sehr Mechanismus des Todes war unbekannt. Allerdings war eine der alten Methoden der Bestrafung Konflikt mit dem Gesetz im Dampfbad verriegelte, wo die Glut war. Der griechische Arzt Galen schlug vor, dass in der Luft gibt es bestimmte Veränderungen, den Schaden verursachen, wenn sie inhaliert werden.
Während des Zweiten Weltkriegs, das Gasgemisch mit Verunreinigungen von Kohlenmonoxid wurde als Treibstoff für Fahrzeuge in jenen Teilen der Welt verwendet, wo es nur eine begrenzte Menge an Benzin und Dieselkraftstoff war. extern (mit einigen Ausnahmen) Generatoren Kohle oder Holzgas festgelegt war, sondern ein Gemisch aus atmosphärischem Stickstoff, Kohlenmonoxid, und kleinen Mengen anderer Gase zu dem Gasmischer zugeführt. Dies war das sogenannte Holzgas.

Die Oxidation von Kohlenmonoxid
Kohlenmonoxid in der partiellen Oxidation von kohlenstoffhaltigen Verbindungen hergestellt. CO entsteht , wenn nicht ausreichend Sauerstoff zu Kohlendioxid (CO 2), beispielsweise zur Erzeugung, während des Betriebes des Ofens oder Verbrennungsmotors in einem geschlossenen Raum. Wenn Sauerstoff vorhanden ist, sowie einige andere atmosphärische Konzentration von Kohlenmonoxid verbrennt, abstrahlenden blaues Licht, Bildung von Kohlendioxid, als Kohlendioxid bekannt.
Kohlendioxid weit bis in die 1960er des letzten Jahrhunderts für Innenbeleuchtung Einrichtungen verwendet wird, Kochen und Heizen, hatte er mit einem Teil des Brennstoffs als Priorität Komponente. Einige Prozesse in modernen Technologien wie Roheisen produzieren noch Kohlenmonoxid als Nebenprodukt. Die Verbindung selbst CO 2 oxidiert wird bei Raumtemperatur zu CO.
Gibt es eine CO in der Natur?
Ob es Kohlenmonoxid in der Natur? Einer seiner natürlichen Ursprungs Quellen sind photochemische Reaktionen in der Troposphäre. Diese Prozesse sind davon ausgegangen , der Lage sein , zu erzeugen , etwa 5 × 10. Dezember kg Mittel e; eute. Unter anderen Quellen, wie oben erwähnt, sind Vulkane, Waldbrände und andere Arten von Verbrennungs.
molekulare Eigenschaften
Kohlenmonoxid hat eine Molmasse von 28,0, die es als Luft etwas weniger dicht macht. Bindungslänge zwischen zwei Atomen – 112,8 Mikrometer. Es ist nahe genug, eines der stärksten chemischen Bindungen zu schaffen. Beiden Elemente in Verbindung mit CO haben etwa 10 Elektronen in der Valenzschale von einem.
In der Regel Verbindungen der organischen Carbonyl- eine Doppelbindung ist. Ein charakteristisches Merkmal des CO-Moleküls ist, was zwischen den Atomen starken Dreifachbindung Elektronen mit diesen teilt 6 3 zugeordnete Molekülorbitale auftritt. Da vier der freigegebenen Elektronen stammen aus einem Sauerstoffatom und 2 nur aus Kohlenstoff, einem besetzten von zwei zugeordneten orbitalen Elektronen von O 2, ein Dipol- oder dative Bindung bilden. Dies bewirkt, dass C ← O Polarisation von Molekülen mit einer geringen Ladung „-“ auf Kohlenstoff und eine geringe Gebühr „+“ auf dem Sauerstoff.
Die verbleibenden zwei zugehörigen Orbitale durch ein geladenes Teilchen von Kohlenstoff und einem Sauerstoff besetzt. Das Molekül ist asymmetrisch: Sauerstoff hat eine größere Elektronendichte als Kohlenstoff und auch leicht positiv geladen ist, verglichen mit einer negativen Kohlenstoff.
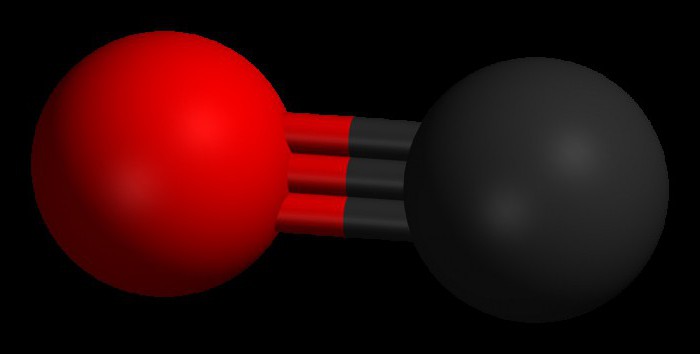
Empfang
In der Industrie wird Erhalt Kohlenmonoxid CO es durch Erhitzen des Kohlendioxids, ohne Zugang von Luft oder Wasserdampf mit der Kohle durchgeführt:
CO 2 + C = 2CO;
H 2 O + C = CO + H 2.
Letzteres wird auch die resultierende Mischung wurde mit Dampf oder Synthesegas. Unter Laborbedingungen Kohlenmonoxid II durch die organische Säure Schwefelsäure unterworfen wird eingeengt, das als Dehydratisierungsmittel wirkt:
HCOOH = CO + H 2 O;
H 2 C 2 O 4 = CO 2 + H 2 O.
Die wichtigsten Symptome und Hilfe bei der CO-Vergiftung
Ist Kohlenmonoxid-Vergiftung? Ja, und sehr stark. Kohlenmonoxid-Vergiftung ist das häufigste Phänomen in der ganzen Welt. Die häufigsten Symptome sind:
- ein Schwächegefühl;
- Übelkeit;
- Schwindel;
- Müdigkeit;
- Reizbarkeit;
- Appetitlosigkeit;
- Kopfschmerzen;
- Desorientierung;
- verschwommenes Sehen;
- Erbrechen;
- Ohnmacht;
- Krämpfe.
Die Exposition gegenüber dem giftigen Gas kann erhebliche Schäden verursachen, die oft zu langfristigen chronischen Krankheitszuständen führen kann. Kohlenmonoxid ist in der Lage zu schweren Schäden für den Fötus einer schwangeren Frau. Opfer, zum Beispiel nach einem Brand, sollten sofort Hilfe bieten. eine dringende Notwendigkeit, einen Krankenwagen zu rufen, gibt Zugang zu frischer Luft, saubere Kleidung Atmung behindern, beruhigen, warm. Schwere Vergiftungen sind in der Regel nur unter der Aufsicht von Ärzten im Krankenhaus behandelt.
Anwendung
Kohlenmonoxid ist, wie bereits erwähnt, ist giftig und gefährlich, aber es ist eine der basischen Verbindungen, die für die organische Synthese in der modernen Industrie verwendet werden. CO wird reine Metalle verwendet , zu erzeugen, Carbonyle, Phosgen, Kohlenstoffsulfid, Methylalkohol, Formamid, aromatische Aldehyde, Ameisensäure Säure. Diese Substanz wird auch als Brennstoff verwendet wird. Trotz seiner Toxizität und Toxizität, wird es oft als Rohstoff für die Herstellung von verschiedenen Substanzen in der chemischen Industrie eingesetzt.
Kohlenmonoxid und Kohlendioxid: Was ist der Unterschied?
Kohlenmonoxid und Kohlendioxid (CO und CO 2) wird oft fälschlicherweise für sie. Beide Gase sind geruchlos, farblos, und beide haben einen negativen Einfluss auf das Herz-Kreislauf-System. Beide Gase können in den Körper durch Inhalation, Haut- und Augen ein. Diese Verbindungen bei Einwirkung von lebenden Organismen teilen eine Reihe von Symptomen – Kopfschmerzen, Schwindel, Krämpfe und Halluzinationen. Die meisten Menschen machen den Unterschied kaum und nicht erkennen , dass die Autoabgase als CO emittiert wird , und CO 2. Innerhalb der Erhöhung der Konzentration dieser Gase können auf ihren Einfluss unterliegen menschlichen Gesundheit und Sicherheit, gefährlich sein. Was ist der Unterschied?
Bei hohen Konzentrationen von beiden kann tödlich sein. Der Unterschied liegt darin , dass die CO 2 ist ein gemeinsames Erdgas, notwendig , dass alle Pflanzen und Tiere. CO ist nicht alltäglich. Dieses Nebenprodukt sauerstofffreie Verbrennung. Die kritische chemischen Unterschied, dass CO 2 hat ein Kohlenstoffatom und zwei Sauerstoffatom, während nur durch eine ihnen ein Co. Kohlendioxid ist nicht brennbar, während Kohlenmonoxid wahrscheinlicher ist, Feuer zu fangen.
Kohlendioxid natürlich in der Atmosphäre festgestellt wird, Menschen und Tiere Sauerstoff und ausgeatmeten Kohlendioxid atmen, d.h. Wesen es kann eine kleine Menge widerstehen. Dieses Gas wird auch von Pflanzen für die Photosynthese benötigt. Jedoch tritt Kohlenmonoxid nicht natürlich in der Atmosphäre und kann gesundheitliche Probleme selbst bei niedrigeren Konzentrationen verursachen. Beide Gasdichte ist auch anders. Kohlendioxid ist schwerer und dichter als Luft, während Kohlenmonoxid etwas einfacher ist. Diese Besonderheit wird bei der Festlegung der geeigneten Sensoren in den Häusern berücksichtigt.