Was ist Allotropie? Allotrop von Kohlenstoff, Chemistry
Gründe Vielzahl von organischen Verbindungen, – die Fähigkeit, verschiedene Kohlenstoffketten und Zyklen zu bilden, miteinander verbunden sind. Das ist das Phänomen der Isomerie. Und der Grund für die Vielzahl von einfachen anorganischen Substanzen? Es stellt sich heraus, dass Sie diese Frage beantworten kann, indem man bedenkt, was Allotropie. Es ist mit diesem natürlichen Phänomen in der Welt der chemischen Elemente, die Existenz verschiedener Formen von einfachen Verbindungen binden.
Was ist Allotropie?
Reagieren auf diese Frage so. Dieses Phänomen ist die Existenz des gleichen chemischen Elements in Form von mehreren einfachen Substanzen. Das heißt, wenn die Zelle 118 im Periodensystem, ist es nicht, dass die gleiche Anzahl von Atomen in der Natur bedeuten. Jedes der Elemente (fast alle) hat eine oder mehr Sorten oder allotropen Modifikationen.
Was ist anders als solche Substanzen? Die Gründe für das Phänomen handelt es sich im Grunde genommen zwei:
- eine andere Anzahl von Atomen im Molekül (Allotropie Zusammensetzung);
- ungleiche Gitterstruktur (Allotropie Form).
Oft wird der Begriff mit dem Begriff Polymorphismus verbunden. Allerdings gibt es einen Unterschied zwischen ihnen. Was ist Allotropie? Diese Modifikation der chemischen Elemente in verschiedenen einfachen Substanzen, und zwar unabhängig davon, ob es in jedem Aggregatzustand ist. Während Polymorphismus – ist dieses Konzept nur auf feste anwendbar kristallinen Substanzen.
Verschiedene allotropen Modifikationen Verbindungen in der Regel von lateinischen Buchstaben vor dem Namen bezeichnet. Alpha wird immer vor der Form angeordnet, die eine Mindestschmelztemperatur des Kochens aufweist. Weiter unten in das Alphabet und eine Zunahme der Leistung auf.
Obwohl das chemische Element in der Basis der einfachen Substanz die gleichen, Modifikationen Eigenschaften deutlich voneinander verschieden, und beide physikalische und chemische. Der einfachste Weg, um die allotropen Formen zu bilden:
- Nichtmetalle (mit Ausnahme von Halogenen und Inertgasen);
- Halbmetalle.
Am wenigsten Allotropie Metalle untersucht, da sie eine nur ungern solche Modifikationen und nicht alle bilden. Insgesamt bis heute gibt es mehr als 400 verschiedene Formen von einfachen Substanzen. Je mehr Oxidationscharakteristik des Elements, desto größer ist die Anzahl von bekannten allotropen Modifikationen zu.

Kohlenstoffmodifikationen
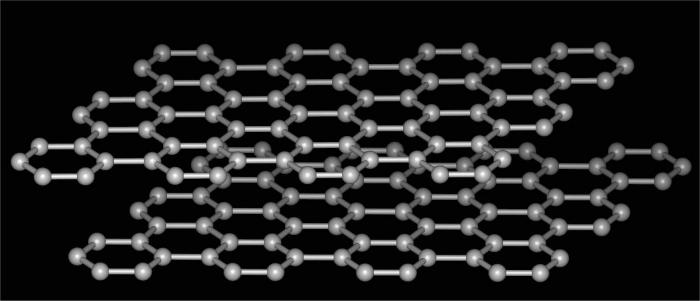
allotrope Kohlenstoff – ist die häufigste und markantes Beispiel das fragliche Phänomen veranschaulicht. Schließlich ist dieses Element mehrere Arten von unterschiedlicher Kristallgitterstruktur bildenden Verbindungen fähig ist. In diesem Bild einer einfachen Substanz, wie polare Gegensätze in ihren Eigenschaften, die Entscheidungen sind links von der Natur zu fragen.
Somit umfasst ein Allotrop von Kohlenstoff die folgenden Modifikationen.
- Was für ein allotrope Kohlenstoff ist, kann zurückverfolgt und neben seiner Form, die von der vorherigen unterscheidet sich grundlegend. Dieser Graphit. Sehr weiche Substanz, die leicht abblättert und ein Unterscheidungszeichen auf dem Papier hinterlassen. Daher ist seine Verwendung zur Herstellung von Griffen einfache Bleistifte. Die Struktur dieser Form – die hexagonale geschichtet. Verbindungen zwischen den Schichten sind schwach, leicht zerrissen, Material mit geringer Dichte. Graphit wird verwendet, synthetische Diamanten als Festschmierstoff zu erzeugen, für die Herstellung von Elektroden, die als Kunststoff Füllstoff und in Kernreaktoren.
- Fullerene – ein weiterer Beweis dafür, dass es Allotropie. Chemie dieser Verbindungen ist ähnlich zu derjenigen der aromatischen Kohlenwasserstoffe. Weil ihre Struktur konvex geschlossene Polyeder, ähnlich einem Fußball. Fullerene sind als Halbleiter im Stand der Technik für die Herstellung von supraleitenden Verbindungen, die als Photoresist und andere angewandt.
- Lonsdalite tserafit und – zwei weitere kristalline allotrope Modifikation von Kohlenstoff. Es wurde vor relativ kurzer Zeit entdeckt. Durch die sehr ähnliche Eigenschaften wie Diamant, in Abwesenheit von Verunreinigungen kann noch schwieriger mehrmals sein.
- Kohle und Ruß – Allotropie amorphe Substanzen. Eingesetzt als Kraftstoff, Schmierstoffe, Filter und so weiter. Nach dem Inhalt in der Natur der am häufigsten von allen Modifikationen des Kohlenstoffs.

Diamant
Die härteste aller bekannten Substanzen bis heute schätzungsweise 10 Punkte auf der Mohs – Skala. Die kristalline Form von Kohlenstoff, die Struktur von der Form richtig miteinander verbundene tetraedrischen Netzwerkeinheiten.
Diamant ist sehr gut in der Lage, Licht zu streuen, kann es als Schmuck (Diamanten) verwendet werden. Aufgrund seiner hohen Härte, ist zum Schneiden und Schweißen, Bohren, Polieren und Schleifen verwendet. Heute startete die Produktion von künstlichen Diamanten in der Industrie verwendet.
andere Arten
Außerdem gibt es mehrere Varianten dieses Elements:
- Nanoröhren;
- Nanofoam;
- Astro;
- Nanofasern;
- glasig;
- Graphit;
- Karabiners;
- nanobuds.
Wahrscheinlich, aber vermeintliche Formen der Existenz von einfachen Kohlenstoffverbindungen: chaoit, Kohlenstoff und Metall dicarbon.
Sauerstoff Allotropie
Dies bildet zwei Nichtmetall einfache Substanz:
- Sauerstoffgas (bei Normalbedingungen), die Formel , welche O 2;
- Ozongas, die empirische Zusammensetzung mich Reflexion O 3.
Es ist offensichtlich, dass hier ist der Hauptgrund für die Existenz von Modifikationen – Molekül. Normaler Sauerstoff – die Lebensgrundlage für alle Lebewesen (mit Ausnahme von anaeroben Bakterien). Er ist ein aktiver Teilnehmer in dem Gasaustausch, die Energiequelle für alle Lebensprozesse. Chemisch – Oxidationsmittel, wodurch eine Vielzahl von Reaktionen durchgeführt.
Ozon wird in der Natur oder spezielle Laborausrüstung Ozonisatoren Sauerstoff aus Luft durch eine starke elektrische Entladung gebildet. Unter natürlichen Bedingungen – es ist ein Blitz. Bei niedrigeren Konzentrationen von Spuren hat es eine angenehmen Geruch frisch (nach dem Sturm immer in der Luft gefühlt). Es ist ein sehr starkes Oxidationsmittel, Bleichmittel, chemisch aktiv.

Phosphormodifizierung
Allotropie Sauerstoff ist ähnlich dem des Phosphors und. Es hat auch etwa 11 verschiedene Modifikationen unterschiedliche Anzahl der Atome im Molekül, und daher für eine chemische Bindung und Eigenschaften. Es gibt drei stabile Formen, und der Rest, in der Natur praktisch nicht auftritt, und abklingenden.
- Weißer Phosphor. Es Formel F 4. Eine Substanz ähnelt Rohvaseline oder leicht gelbliche Farbe. Es ist leicht zu schmelzen, Drehen in Giftgas.
- Roter Phosphor – eine Paste, die einen unangenehmen Geruch hat. Formel – P n. Diese Polymerstruktur.
- Schwarzer Phosphor – fühlt sich fettig an Gewicht, die in Farbe und vollständig in Wasser löslich ist schwarz.
Metall-Modifikation
Was Allotropie Metalle sind, kann am Beispiel von Eisen zu finden. Es existiert in Form von:
- alpha;
- beta;
- gamma;
- Sigma-Form.
Jeder unterscheidet sich von der bisherigen Struktur des Kristallgitters und dementsprechend Eigenschaften. Zum Beispiel alpha-Form – ferromagnetichna und Beta -paramagnetik.
Im allgemeinen können alle bekannten Metalle aus allotropen Modifikation insgesamt 27 chemische Elemente zu bilden.

Zinn Allotropie
Interessant, dass die alpha-Form – ein graues Pulver, das nur bei niedrigeren Temperaturen existiert. Beta-Form, auf der anderen Seite, Metall, silberweiß, weich und dehnbar. Es ist bei Hochtemperaturleistung – bis zu 161 ° C. Eine Form ohne weiteres zu einem anderen in vivo umgewandelt wird, wenn Grad Abfall.


















