Einfache und komplexe Proteine. Die Struktur, Funktionen, Eigenschaften, Merkmale, Beispiele von komplexen Proteinen
Eine der Definitionen des Lebens ist wie folgt: „Das Leben der Art der Existenz von Proteinkörpern ist.“ Auf unserem Planeten ohne Ausnahme Organismen enthalten solche organischen Materialien, wie Proteine. Dieser Artikel wird die einfache und komplexe Proteine identifiziert Unterschiede in der molekularen Struktur beschreiben, und diskutiert ihre Funktionen in der Zelle.
Was sind Proteine
Aus der Sicht der Biochemie – eine hochmolekulare organische Polymere, Monomere, die 20 verschiedenen Arten von Aminosäuren sind. Sie werden zusammen durch kovalente chemische Bindungen verbunden sind, auch bekannt Peptid. Da Protein – Monomere sind amphotere Verbindungen enthalten sie sowohl eine Aminogruppe als auch eine carboxylfunktionelle Gruppe. Chemische Bindung CO-NH zwischen ihnen auftritt.
Wenn das Polypeptid aus den Aminosäureresten Verbindungen besteht, bildet es ein einfaches Protein. Die Moleküle des Polymeren, das fern Metallionen, Vitamine, Nucleotide, Kohlenhydrate – sind komplexe Proteine. Als nächstes betrachten wir die räumliche Struktur von Polypeptiden.
Ebenen der Organisation von Proteinmolekülen
Sie sind in vier verschiedenen Konfigurationen vorgestellt. Die erste Struktur – lineare, ist es am einfachsten und hat die Form einer Polypeptidkette während der die Bildung zusätzlicher Wasserstoffbindungen windet. Sie stabilisieren die Helix, die eine Sekundärstruktur genannt wird. Hochschulen haben einfache und komplexe Proteine, die Mehrheit der pflanzlichen und tierischen Zellen. Das letztere Konfiguration – quaternäres entsteht im Zusammenspiel mehrerer Moleküle der nativen Struktur, vereinigten Coenzyme, nämlich solche Proteine haben komplexe Struktur, Betrieb in verschiedenen Körperfunktionen.
Eine Vielzahl von einfachen Proteinen
Diese Gruppe ist nicht zahlreiche Polypeptide. Ihre Moleküle bestehen nur aus Aminosäureresten. So schließen Proteine wie Histone und Globulin. Die erste in der Kernstruktur dargestellt wird, und sind mit den DNA-Molekülen kombiniert wird. Die zweite Gruppe – Globuline – sind die Hauptbestandteile von Blutplasma. Solch ein Protein, wie Gammaglobulin, führt die Funktionen der Immunabwehr und ist ein Antikörper. Diese Verbindungen können Komplexe, die enthalten komplexe Kohlenhydrate und Proteine bilden. Solche fibrillären einfache Proteine wie Kollagen und Elastin, sind Teil des Bindegewebe, Knorpel, Sehnen, Haut. Ihre Hauptfunktion – die Konstruktion und Unterstützung.
Tubulin-Protein ist ein Mitglied von Mikrotubuli, die Bestandteile von Zilien und Geißeln Einzeller wie Ciliaten sind, Euglena, parasitären Flagellaten. Das gleiche Protein ist ein Mitglied von mehrzelligen Organismen (Flagellen Spermien, Eizellen Zilien, Flimmerepithel des Dünndarms).
Protein Albumin dient eine Funktion (zB ein Protein von Hühnereiern) einzudecken. Im Endosperm von Samen von Getreide – Roggen, Reis, Weizen – Proteinmoleküle akkumulieren. Sie heißen zellulären Einschlüssen. Diese Stoffe werden in dem Samen Embryo am Anfang seiner Entwicklung. Darüber hinaus ist der hohe Proteingehalt des Weizens Rüsselkäfers ein sehr wichtiger Indikator für die Qualität des Mehls. Brot gebacken von Gluten reichem Mehl hat eine hohe Geschmacksqualität und nützlicher. Gluten enthalten sogenannte Hartweizen. Die Tiefseefische Blutplasma enthält Proteine, die den Tod von der Kälte zu verhindern. Sie besitzen die Frostschutzeigenschaften, den Tod des Organismus bei niedrigeren Wassertemperaturen zu verhindern. Auf der anderen Seite, in der Zusammensetzung der Zellwand von thermophilen Bakterien in geothermischen Quellen enthaltenen Proteine in der Lage zu seiner natürlicher Konfiguration (tertiäre oder quaternäre Struktur) zu erhalten und nicht denaturiert bei Temperaturen im Bereich von +50 bis + 90 ° C.
Eiweiss
Dies sind komplexe Proteine, die durch eine große Vielfalt in Verbindung mit den verschiedenen Funktionen, die von ihnen ausgeführt gekennzeichnet sind. Wie zuvor erwähnt, enthält die Gruppe von Polypeptiden, mit Ausnahme der Proteinteil eine prosthetische Gruppe. Unter dem Einfluss von verschiedenen Faktoren, wie hohe Temperatur, Schwermetallsalze, Alkali- und konzentrierte Säure-Komplex-Proteine kann seine Raumform, vereinfacht es verändern. Dieses Phänomen wird als Denaturierung bezeichnet. Die Struktur von komplexen Proteinen ist Wasserstoffbrückenbindungen aufgebrochen werden aufgebrochen, und die Moleküle verlieren ihre Eigenschaften und Funktionen. In der Regel ist die Denaturierung irreversibel. Aber einige der Polypeptide als Katalysator wirken, Lenk- und Signalisierungsfunktionen ist es möglich, Renaturierung – Wiederherstellung der natürlichen Struktur des Eiweisses.

Wenn die Aktion ein destabilisierender Faktor für eine lange Zeit geht, wird das Proteinmolekül vollständig zerstört. Dies führt zum Bruch der Peptidbindungen der Primärstruktur. Wiederherstellen Protein und seine Funktion ist nicht mehr möglich. Dieses Phänomen wird als Zerstörung genannt. Ein Beispiel ist das Kochen von Eiern: liquid Protein – Albumin, in der Tertiärstruktur befindet sich vollständig zerstört.
Proteinbiosynthese
Wieder einmal erinnern, daß in den Polypeptiden von lebende Organismen besteht aus 20 Aminosäuren, von denen einige unersetzlich sind. Dieses Lysin, Methionin, Phenylalanin, und so weiter. D. Sie treten in den Blutstrom aus dem Dünndarm, nachdem sie Proteinprodukte zu splitten. An essentiellen Aminosäuren (Alanin, Prolin, Serin) zu synthetisieren, Pilzen und Tieren verwenden, stickstoffhaltige Verbindungen. Pflanzen, autotroph sind, unabhängig voneinander ein notwendiger Bestandteil Monomere repräsentiere komplexe Proteine bilden. Für diese Assimilation Reaktionen werden sie verwendet, Nitrate, Ammoniak oder Stickstoff frei. Bei einigen Arten von Mikroorganismen bieten sich mit einem kompletten Satz von Aminosäure, während in anderen nur einige Monomere synthetisiert werden. Die Stufen der Biosynthese von Proteinen auftreten, in den Zellen aller Lebewesen. Im Kern der Transkription stattfindet, und in dem Zytoplasma der Zelle – Sendung.
Der erste Schritt – die Synthese der mRNA-Vorstufe auftritt, durch das Enzym RNA-Polymerase. Er bricht die Wasserstoffbrückenbindungen zwischen den DNA-Ketten, und einer von ihnen auf dem Prinzip der Komplementarität sammelt prä-mRNA-Molekül. Es ist slaysingu ausgesetzt, dass reif ist, und dann kommt aus dem Zellkern in das Zytoplasma, Boten-Ribonukleinsäure bilden.
Um die zweite Stufe Umsetzung erfordert eine spezifische Organellen – Ribosomen und molekulare Informationen und Transfer-Ribonukleinsäuren. Eine weitere wichtige Bedingung ist die Anwesenheit von ATP, wie die Reaktionen Kunststoffmetabolismus, die mit Absorption von Energie auf die Biosynthese von Proteinen tritt gehört.
Enzyme, deren Struktur und Funktion
Dies ist eine große Gruppe von Proteinen (etwa 2000), die Durchführung der Rolle der Substanzen, die Rate der biochemischen Reaktionen in den Zellen zu beeinflussen. Sie können einfach (trepsin, Pepsin) oder komplex sein. Komplexe Proteine von Apoenzym und Coenzym bestehen. Die Spezifität des Proteins im Vergleich zu den Verbindungen, für die sie wirkt, bestimmt einen Coenzym, und Eiweiss Aktivität ist nur in dem Fall beobachtet, wo die Proteinkomponente mit dem Apoenzym verbunden. Die katalytische Aktivität des Enzyms unabhängig von dem Moleküle, aber nur durch das aktive Zentrum. Seine Struktur entspricht der chemischen Struktur der Stoffe nach dem Prinzip der „key-lock“ katalysiert, so dass die Wirkung von Enzymen streng spezifisch ist. Funktionen komplexer Proteine sind in der Teilnahme an Stoffwechselprozessen und in sie als Akzeptoren verwenden.
Klassen von komplexen Proteinen
Sie wurden von Biochemikern entwickelt, basierend auf 3 Kriterien: physikalisch-chemische Eigenschaften, Merkmale und strukturelle Merkmale Eiweiss Spezifität. Die erste Gruppe umfasst das Polypeptide von elektrochemischen Eigenschaften unterscheiden. Sie sind in Grund aufgeteilt, neutral und sauer. Relativ zu den Wasser-Proteine können hydrophil, amphiphil und hydrophob sein. Die zweite Gruppe von Enzymen, die bisher in Betracht gezogen worden sind. Die dritte Gruppe umfasst Polypeptide, die in ihrer chemischen Zusammensetzung unterscheiden prosthetische Gruppe (chromoproteids ist, Nukleoproteinen, Metalloproteine).
Betrachten Sie die Eigenschaften komplexer Proteine im Detail. So kann beispielsweise die saure Proteinteil von Ribosomen ist, enthält 120 Aminosäuren und ist vielseitig. Es ist in den Protein-Synthese Organellen, sowohl prokaryotische als auch eukaryotische Zellen entfernt. Ein weiteres Mitglied dieser Gruppe – S-100-Protein, besteht aus zwei Ketten Calciumion gebunden. Er ist Mitglied von Neuronen und Glia – Gewebe des Nervensystems zu unterstützen. Die gemeinsame Eigenschaft aller sauren Protein – ein hoher Gehalt an Dicarbonsäuren: Glutaminsäure und Asparaginsäure. Durch alkalische Proteine umfassen Histone – Proteine, die Nukleinsäuren RNA und DNA. Die Besonderheit der chemischen Zusammensetzung ist die große Menge an Lysin und Arginin. Histone, zusammen mit der Kernchromatin Chromosom Form – kritischer Zellstruktur Vererbung. Diese Proteine werden in den Prozessen der Transkription und Translation beteiligt. Amphiphile Proteine weitgehend in Zellmembranen dargestellt, ein Lipoprotein Bilayer bilden. Somit ist die Gruppe, die die oben diskutierten komplexen Proteine untersucht, waren wir überzeugt, dass ihre physikalisch-chemischen Eigenschaften aufgrund der Struktur der Proteinkomponente und prosthetische Gruppen.
Einige komplexe Zellmembranproteine sind in der Lage eine Vielzahl von chemischen Verbindungen, wie Antigene zu erkennen und auf sie reagieren. Diese Meldefunktion Eiweiss, es ist sehr wichtig für die selektiven Absorptionsverfahren, Substanzen aus der äußeren Umgebung, und sie zu schützen.
Glykoproteine und Proteoglykane
Sie sind komplexe Proteine, die zwischen einer biochemischen Zusammensetzung prosthetische Gruppen unterscheiden. Wenn die chemischen Bindungen zwischen dem Protein-Komponente und der Kohlenhydratanteil – kovalent-Glycosid werden solche Substanzen Glykoproteine bezeichnet. Apoenzym sie präsentierten Moleküle von Mono- und Oligosaccharide, Beispiele für solche Proteine sind Prothrombin, Fibrinogen (Proteine, die in der Blutgerinnung beteiligt sind). Kortiko- und gonadotropen Hormone, Interferone, Enzyme und Membran sind Glykoproteine. In Proteoglykan-Moleküle Proteinteil ist nur 5%, wobei der Rest eine prosthetische Gruppe (geteropolitsaharid) ist. Beide Teile sind durch eine glykosidische Bindung der OH-Gruppe-Threonin und Arginin-Gruppen und NH₂-Glutamin und Lysin verbunden. Proteoglykanmoleküle spielt eine sehr wichtige Rolle in den Wasser-Salz-Stoffwechsel Zellen. Unten finden Sie eine Tabelle von komplexen Proteinen ist, haben wir untersucht.
| Glykoproteine | Proteoglykane |
| Baukomponenten von prosthetischen Gruppen | |
| 1. Monosaccharide (Glucose, Galactose, Mannose) | 1. Hyaluronsäure |
| 2. Oligosaccharide (Maltose, Laktose, Saccharose) | 2. Chondroitin Säure. |
| 3. Die acetylierten Aminoderivate von Monosacchariden | 3. Heparin |
| 4. Dezoksisaharidy | |
| 5. Neuraminsäure und Sialinsäuren | |
Metalloproteinen
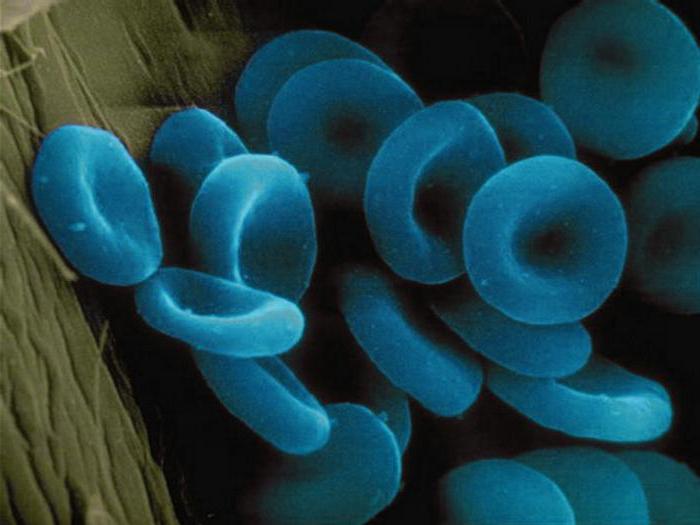
Diese Materialien enthalten als Teil ihrer molekularen Ion von einem oder mehreren Metallen. Betrachten wir Beispiele für komplexe Proteine der obigen Gruppe gehören. Es ist vor allem die Enzyme wie Cytochrom-Oxidase. Es basiert auf der Cristae der Mitochondrien befindet und aktiviert die Synthese von ATP. Ferrin und Transferrin – eiweisshaltige Eisenionen. Origin Ablagerungen sie in den Zellen, und der zweite ist der Transport von Blutprotein. Ein weiterer Metalloproteine – alfaamelaza sie Kalziumionen enthält , wird in der mitgelieferten Zusammensetzung des Speichels und der Bauchspeicheldrüse, in der Spaltung von Stärke beteiligt. Hämoglobin ist wie Metalloproteinen und hromoproteidov. Er dient als Transportprotein, das Sauerstoff trägt. Das Ergebnis ist eine Verbindung von Oxyhämoglobin. Das Einatmen von Kohlenmonoxid oder kohlenmonoxid genannt, dessen Hämoglobinmoleküle bilden sehr stabile Verbindung Erythrozyten. Es breitet sich schnell auf Organe und Gewebe, Zellvergiftung verursachen. Als Folge kommt es nach längerem Einatmen von Kohlenmonoxid Tod durch Ersticken. Hämoglobin teilweise trägt und Kohlendioxid in den katabolen Prozessen gebildet. Aus dem Blutstrom von Kohlendioxid in die Lunge und Niere, und von ihnen – an die äußeren Umgebung. Einige Krebs- und Weichtiere Transportprotein, das Sauerstoff trägt, ist das Schlüsselloch. Anstelle des Eisens enthält es Kupferionen, so tierisches Blut ist nicht rot und blau.
Chlorophyll-Funktion
farbige organische Substanzen – Wie bereits erwähnt, können komplexe Proteine Komplexe mit Pigmenten bilden. Ihre Farbe ist abhängig von hromoformnyh Gruppen, die selektiv bestimmte Spektren von Sonnenlicht absorbieren. In Pflanzenzellen hat grüne Plastiden – Chloroplasten enthalten Chlorophyll Pigment. Es besteht aus Magnesiumatomen und einem mehrwertigen Alkohol, Phytol. Sie sind mit Proteinmolekülen verbunden sind, und selbst enthalten Chloroplasten Thylakoide (Platten), oder die Membran in den Stapeln zugeordneten – Facette. Sie sind photosynthetischen Pigmente – Chlorophyll – und zusätzliche Carotinoide. Hier sind alle in den photosynthetischen Reaktionen verwendeten Enzyme. So chromoproteids, die Chlorophyll enthalten, führen wichtige Funktionen im Stoffwechsel, nämlich in Reaktionen Assimilation und Dissimilation.
virale Proteine
Dazu gehören Vertreter der nicht-zellulären Lebensformen, Eintritt in das Reich Vir. Viren haben keine eigene Protein-Synthesevorrichtung. Nukleinsäuren, DNA oder RNA kann die Synthese der meisten Partikel eigene Zellen mit einem Virus infiziert induzieren. Einfache Viren bestehen nur aus Proteinmolekülen, kompakt in einer helikalen Struktur montiert oder eine polyedrische Form, wie Tabak-Mosaik-Virus. Komplexe Viren haben zusätzliche Membran der Plasmamembran der Wirtszelle, die Teil. Wie es Glykoproteine (Hepatitis-B-Virus, Pockenvirus) umfasst. Die Hauptfunktion der Glykoproteine – eine Erkennung spezifischer Rezeptoren auf der Wirtszellmembran. Die Zusammensetzung von zusätzlichen viralen Membranen und Proteine umfassen Enzyme Bereitstellen reduplication von DNA oder RNA – Transkription. Viruspartikel-Proteine shells hat eine spezifische Struktur, in Abhängigkeit von den Membranproteinen der Wirtszelle: Basierend auf dem Vorstehenden kann man die folgende abschließt.
In diesem Artikel haben wir die Eigenschaften von komplexen Proteinen gegeben, studierten ihre Struktur und Funktion in Zellen verschiedenen Organismen.









