… reduzierende Eigenschaften haben Redoxeigenschaften
Redox-Eigenschaften einzelner Atome und Ionen sind ein wichtiges Thema in der modernen Chemie. Dieses Material hilft, die Aktivität der Elemente und Substanzen zu erklären, einen detaillierten Vergleich der chemischen Eigenschaften der einzelnen Atom zu leiten.

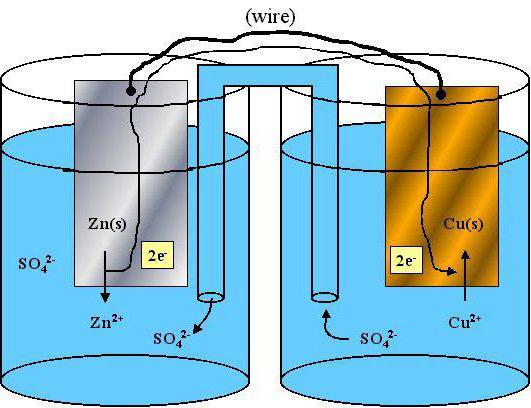
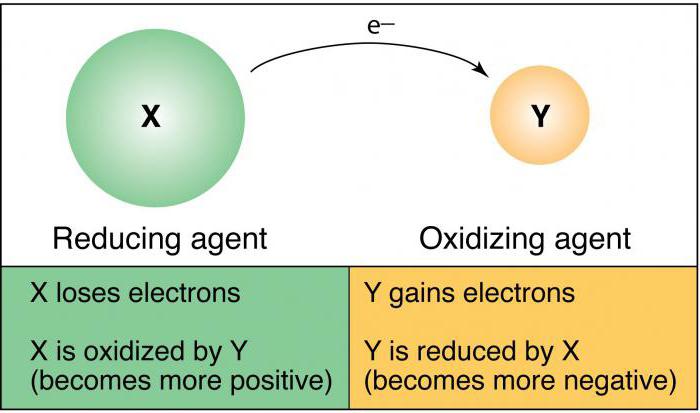
Was ist das Oxidationsmittel
Viele Probleme in der Chemie, einschließlich Testfragen der einheitlichen staatlichen Prüfung in Klasse 11 und JEG in der 9. Klasse, mit diesem Konzept verbunden. Das Oxidationsmittel wird Atom oder Ionen in Betracht gezogen, die im Verlauf der chemischen Wechselwirkung von Elektronen von einem anderen Ion oder Atom akzeptieren. Wenn wir die oxidierenden Eigenschaften der Atome müssen analysieren Periodensystems der Mendelejew. In der Zeit, die in der Tabelle angeordnet sind, von links nach rechts, die Oxidationsfähigkeit der Atome zunimmt, dh haben eine ähnliche nicht-metallische Eigenschaften. Der Hauptuntergruppen ähnliche Parameter nach unten abnimmt. Unter den mächtigsten einfachen Substanzen eine Oxidationsfähigkeit, Bleifluorid. Ein Begriff wie „Elektronegativität“ ist es möglich, ein Atom in dem Fall der chemischen Wechselwirkung der Elektronen zu tragen, kann oxidativen Eigenschaften auch in Betracht gezogen werden. Unter komplexe Stoffe, die aus zwei oder mehreren chemischen Elementen bestehen kann hell Oxidantien in Betracht gezogen werden: Kaliumpermanganat, Kaliumchlorat, Ozon.

Was ist das Reduktionsmittel
Mindernden Eigenschaften typisch für Atome der einfachen Substanzen aufweist metallischen Eigenschaften. In Perioden des Periodensystems in den metallischen Eigenschaften, links geschwächt und in wichtigen Untergruppen (vertikal), werden sie verstärkt. Das Wesen der Erholung der Auswirkungen der Elektronen, die auf dem äußeren Energieniveau befinden. Je größer die Zahl der Elektronenschalen (Level), desto leichter während der chemischen Wechselwirkung der „extra“ Elektronen zu senden.
Ausgezeichnete reduzierende Eigenschaften haben aktive (Alkali, Erdalkali) Metalle. Zusätzlich aufweisende Substanzen ähnlicher Parameter, die das Schwefeloxid (6), Kohlenmonoxid unterscheiden. Um den maximalen Oxidationsgrad zu erhalten, müssen die Verbindungen reduzierenden Eigenschaften zeigen.
Das Oxidationsverfahren
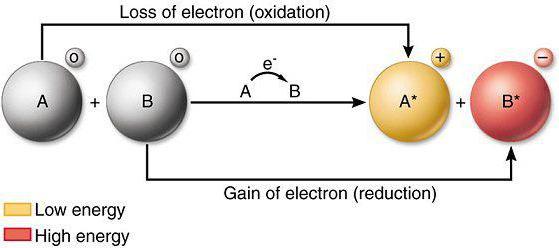
Wenn während der chemischen Wechselwirkung des Atoms oder Ions Elektronen an ein anderes Atom (Ion) verliert, bezieht sich auf den Prozess der Oxidation. Für eine Analyse der Auswirkungen von Änderungen Eigenschaften und oxidativen Abbau von Kapazitäten, erforderlichen Elemente des Periodensystems, sowie Kenntnisse über die aktuellen Gesetze der Physik.

Recovery-Prozess
Reduktionsverfahren beinhalten die Einführung von Ionen oder Elektronen, die durch andere Atome Atomen (Ionen) während der direkten chemischen Wechselwirkung. Ausgezeichnete Reduktionsmittel sind Nitrite, Sulfite von Alkalimetallen. Mindernden Eigenschaften der Elemente in dem Systemmetalleigenschaften ähnlich zu einfachen Substanzen ändern.
Algorithmus Analyse OVR
Um bereit chemische Reaktion des Schülers die Koeffizienten zu arrangieren, müssen Sie einen speziellen Algorithmus verwenden. Redoxeigenschaften helfen, eine Vielzahl von Design-Aufgaben in der analytischen, organisch, allgemeiner Chemie zu lösen. Bestellen Sie bieten eine Analyse der Reaktion:
- Erstens ist es wichtig, jedes Element verfügbar Oxidationszustand zu definieren, werden die Regeln.
- Weiter definieren diese Atome oder Ionen, die ihre Oxidationsstufe in der Reaktion beteiligt sein geändert haben.
- Marks „minus“ und „plus“ gibt die Anzahl der Besetzung während der chemischen Reaktion der freien Elektronen angenommen.
- Ferner ist zwischen der Anzahl der Elektronen wird durch die minimale gemeinsame Vielfachen, das heißt eine ganze Zahl bestimmt, die von akzeptierten und ergaben Elektronen gleichmäßig teilbar ist.
- Dann wird sie in Elektronen aufgeteilt in chemischen Reaktionen beteiligt.
- Als nächstes bestimmen wir genau, welche Ionen oder Atome haben reduzierende Eigenschaften sowie Oxidantien bestimmen.
- In der letzten Stufe der Pose-Koeffizienten in Gl.
Anwendungsverfahren der elektronischen Waage, um die Koeffizienten in einem bestimmten Reaktionsschema zu platzieren:
NaMnO 4 + Schwefelsäure + Schwefelwasserstoff = S + Mn SO 4 + … + …
Algorithmus zur Lösung dieses Problems
Wir finden heraus, genau das, was nach der Wechselwirkung von Materie gebildet werden soll. Da die Reaktion bereits Oxidationsmittel ist (sie werden Mangan) und definierten Reduktionsmittel gebildet Substanz (es wird Schwefel), die nicht den Oxidationsgrad ändert. Da die Hauptreaktion zwischen dem Salz und der starken sauerstoffhaltigen Säure nimmt, dann einer der Stirn Substanz ist Wasser, und das zweite – Natriumsalz, genauer gesagt, Natriumsulfat.
Wenden wir uns nun zurückkehren Schema und die Annahme des Elektrons:
– Mn +7 dauert 5 e = Mn +2.
Der zweite Teil des Programms:
– S -2 = S 0 otdaet2e
Wir haben in den ersten Reaktionsraten, nicht zu vergessen, alle Atome, die Schwefel in den Seiten der Gleichung zusammenzufassen.
2NaMnO 4 + 5 H 2 S + 3H 2 SO 4 = 5S 2MnSO + 4 + 8 H 2 O + Na 2 SO 4.
Parsen OVR Wasserstoffperoxid Einbeziehung
die Algorithmus Analyse OVR Anwendung kann die chemische Reaktion zu:
Wasserstoffperoxid + Schwefelsäure + Kalium permagnanat = Mn SO 4 + Sauerstoff + … + …
Oxidation verändert Sauerstoffion (Wasserstoffperoxid) und Mangankation Kaliumpermanganat. Das heißt, ein Reduktionsmittel und ein Oxidationsmittel, wir präsent sind.
Definieren Sie, was ein Material noch nach der Wechselwirkung passieren kann. Einer von ihnen ist Wasser, das offenbar durch die Reaktion zwischen der Säure und Salz dargestellt wird. Kalium keine neue Substanz bildet, wird das zweite Produkt Kaliumsalz, nämlich Sulfat, da die Umsetzung mit Schwefelsäure vorgegangen.
Antrieb:
2O – 2 gibt Elektron und verwandelte sich in O 2 0 5
Mn +7 5 empfängt Elektronen und wird zu einem Ion 2 Mn +2
Wir setzen Raten.
5H 2 O 2 + 3H 2 SO 4 + 2KMnO = 5O 2 4 + 2Mn SO 4 + 8 H 2 O + K 2 SO 4
BEISPIEL Parsen OVR mit Kaliumchromat
die Methode der elektronischen Waage verwendet wird, um eine Gleichung mit Koeffizienten herzustellen:
FeCl 2 + Salzsäure + Kaliumchromat = FeCl 3 + CrCl 3 + … + …
Veränderte Oxidationsstufe Eisen (Eisenchlorid in II) und Chromionen in Kaliumbichromat.
Jetzt versuchen wir herauszufinden, was andere Substanzen gebildet werden. Man kann ein Salz sein. Als Kalium jede Verbindung nicht gebildet wird somit das zweite Produkt ist ein Kaliumsalz, genauer gesagt, Chlorid, weil die Reaktion stattfand, mit Salzsäure.
Um Diagramm:
Fe 2 sendet e = Fe +3 6 Reduktions
2CR +6 6 empfängt e = 2CR +3 1 Oxidierer.
Wir stellen die Koeffizienten in der Anfangsreaktion:
6K 2 Cr 2 O 7 + FeCl 2 + 14HCl = 7H 2 O + 6FeCl 3 + 3 + 2CrCl 2KCl
BEISPIEL Parsen OVR mit Kaliumiodid
mit den Regeln bewaffnet, schaffen eine Gleichung:
Kaliumpermanganat + Schwefelsäure + Kaliumjodid, Mangansulfat + … iod + … + …
Oxidationszustand verändert Mangan und Jod. Das ist das Reduktionsmittel und Oxidationsmittel vorhanden sind.
Jetzt finden wir am Ende heraus, dass wir gebildet haben. Die Verbindung wird Kalium, d.h. Kaliumsulfat erhalten.
Reduktionsverfahren treten in den Jodionen.
Bildet das Elektronentransfer-Schema:
– Mn +7 5 empfängt e = Mn +2 2 ist ein Oxidationsmittel,
– 2I – gibt E = I 2 2 0 5 ist ein Reduktionsmittel.
Wir ordnen die Koeffizienten in der ersten Reaktion, die zwar nicht vergessen, alle Schwefelatome in der Gleichung zusammenzufassen.
210KI + KMnO 4 + 8 H 2 SO 4 = 2MnSO 4 + 2 + 5I 6K 2 SO 4 + 8 H 2 O
Beispiel Parsen OVR mit Natriumsulfit
Mit Hilfe der klassischen Methode, ziehen wir Systeme für die Gleichung auf:
– Schwefelsäure + KMnO 4 + … Natriumsulfit, Natriumsulfat, Mangansulfat + … + … +
Nach der Umsetzung von Natriumsalzwasser erhalten.
Um Diagramm:
– Mn +7 5 empfängt e = Mn +2 2
– S 4 2 sendet e = S 6 5.
Wir ordnen die Koeffizienten in dieser Reaktion ist nicht vergessen, die Schwefelatome Koeffizienten in Einstellung zu setzen.
3H 2 SO 4 + 4 + 5Na 2KMnO 2 SO 3 = K 2 SO 4 + 4 + 5Na 2MnSO 2 SO 4 + 3H 2 O.
Beispiel Parsen OVR mit Stickstoff
Führen Sie die folgenden Aufgaben. Unter Verwendung des Algorithmus, bilden wir eine vollständige Reaktionsgleichung:
– Mangannitrat + Salpetersäure + PbO 2 = HMnO 4 + Pb (NO 3) 2 +
Lassen Sie uns analysieren, was Substanz sogar Formen. Da die Reaktion zwischen einem starken Oxidationsmittel und Salz gehalten wurde, dann ist die Substanz Wasser.
Wir werden die Änderung in der Anzahl der Elektronen zeigen:
– Mn +2 5 e = Mn +7 2 weist die Eigenschaften eines Reduktionsmittels sendet,
– Pb +4 2 erhält e = Pb +2 5 Oxidationsmittel.
3. Wir ordnen die Koeffizienten in der ersten Reaktion sorgfältig aufaddieren alle vorhandenen Stickstoffs in der linken Seite der ursprünglichen Gleichung:
– 2Mn (NO 3) 2 + 3 + 6HNO 5PbO 2 = 4 + 2HMnO 5PB (NO 3) 2 + 2H 2 O.
Bei dieser Reaktion werden reduzierende Eigenschaften nicht Stickstoff manifestiert.
Eine zweite Probe der Redoxreaktion mit Stickstoff:
Zn + Schwefelsäure + HNO 3 = ZnSO 4 + NO + …
– Zn 0 2 sendet e = Zn +2 3 werden Reduktionsmittel,
N +5 3 empfängt e = N +2 2 das Oxidationsmittel ist.
Wir legen die Koeffizienten in einer vorbestimmten Reaktion:
3Zn + 3H 2 SO 4 + 2 HNO 3 = 3ZnSO 4 + 2NO + 4H 2 O.
Die Bedeutung der Redox-Reaktionen
Bekanntestes Reduktionsreaktion – Photosynthese, eine typische Pflanze. Wie die Eigenschaften der Wiederherstellung ändern? Der Prozess findet in der Biosphäre, es führt zu einer Erhöhung der Energie mit einer externen Quelle. Es ist diese Energie und verwendet für ihre Bedürfnisse der Menschheit. Beispiele für Oxidationsreaktionen und in Verbindung mit chemischen Elementen zu reduzieren, sind von besonderer Bedeutung , Umwandlung von Verbindungen von Stickstoff, Kohlenstoff, Sauerstoff. Durch Photosynthese Erdatmosphäre hat eine solche Zusammensetzung, die für die Entwicklung von lebenden Organismen erforderlich ist. Durch die Photosynthese nicht Kohlendioxid im Luftgehäuse erhöhen, wird die Oberfläche der Erde nicht überhitzt. Die Pflanze entwickelt nicht nur durch Redoxreaktion, aber die Formen solcher Stoffe auf den Menschen, wie Sauerstoff, Glukose erwünscht ist. Ohne diese chemische Reaktion kann kein vollständiger Zyklus der Materie in der Natur, sowie die Existenz des organischen Lebens sein.
Praktische Anwendung OVR
Um die Metalloberfläche zu erhalten, ist es notwendig zu wissen, dass die Eigenschaften aktive Metalle hat Verringerung daher ist es möglich, die Oberflächenschicht, die über das aktive Element zu bedecken, wodurch dem Prozess der chemischen Korrosion verlangsamen. Aufgrund der Redoxeigenschaften durch Reinigung und Desinfektion von Trinkwasser. Weder Ein Problem kann nicht ohne korrekt in den Gleichungskoeffizienten angeordnet gelöst werden müssen. Um Fehler zu vermeiden, ist es wichtig, eine Vorstellung über alle Redox-Parameter zu haben.
Schutz gegen chemische Korrosion
Besondere Herausforderung für das menschliche Leben und Aktivität ist Korrosion. Als Ergebnis der chemischen Umwandlung von Metallversagen, ihre Leistung Auto Teile zu verlieren, Werkzeugmaschinen. Um ein solches Problem zu korrigieren, unter Verwendung von Opferschutz, eine Metallüberzugsschicht aus Lack oder Farbe antikorrosive Legierungen anwenden. So wird beispielsweise Stahloberfläche mit einer Schicht aus aktivem Metall bedeckt – Aluminium.
Abschluss
Eine Vielzahl von Reduktionsreaktionen auftreten im Körper, die normale Funktion des Verdauungssystems gewährleisten. Solche grundlegenden Lebensprozesse wie Gärung, Fäulnis, Atmung, auch mit reduzierenden Eigenschaften in Verbindung gebracht. Ähnliche Funktionen, alle Lebewesen auf unserem Planeten. Ohne Reaktion mit Engagement und Akzeptanz von Elektronen nicht Bergbau, industrielle Produktion von Ammoniak, Laugen, Säuren werden. In allen Techniken der analytischen Chemie Maßanalyse auf dem Redoxprozesse basiert. Kampf mit solchen unangenehmen Phänomen der chemischen Korrosion, es wird auch auf dem Wissen über diese Prozesse beruhen.