Die aktive Stelle des Enzyms: Struktur, Eigenschaften. Wer entdeckte das aktive Zentrum des Enzyms? Was ist das aktive Zentrum des Enzyms genannt?
Wir haben alle von Enzymen gehört, aber es ist unwahrscheinlich, dass jeder von uns gründlich genau weiß, wie diese Substanzen angeordnet sind, und warum sie gebraucht werden. Dieser Artikel wird helfen , die Struktur und zu verstehen Funktionen von Enzymen (Enzyme) im Allgemeinen und ihre aktiven Zentren im Besonderen.
Geschichte Forschung
Im Jahr 1833, Französisch Chemiker Anselme Payen identifizieren und die Eigenschaften des Enzyms Amylase beschreiben.
Einige Jahre später, Louis Pasteur, die Umwandlung von Zucker in Alkohol beteiligt Hefe zu studieren, schlug vor, dass dieser Prozess auf die Chemikalien zurückzuführen ist, dass die Hefe bilden.
Am Ende des XIX Jahrhunderts Physiologe geprägt Villi Kyune erstmals den Begriff „Enzym“.
Deutsch Eduard Buchner 1897 identifiziert und beschrieben zymase – Enzym-Komplex, der die Umwandlung von Saccharose in Ethanol katalysiert. In der Natur Zymase in großer Menge in der Hefe.
Es ist nicht bekannt, wann und wer das aktive Zentrum des Enzyms geöffnet. Diese Entdeckung ist mit Nobelpreisträger Chemiker Edaurdu Buchner, amerikanische Biologe James Sumner und andere namhafte Wissenschaftler gutgeschrieben, die sich auf die Untersuchung der enzymatischen Katalyse gearbeitet.

Allgemeine Informationen über Enzyme
Recall, die Enzyme – Substanzen proteinischer Natur, die Funktionen ausführen, in Organismen Katalysatoren chemischer Reaktionen leben. Das Enzym hat Abschnitte, die nicht direkt daran teilnehmen, die Strömung des Reaktions ein aktives Zentrum des Enzyms bereitstellt.
Hier sind einige der Eigenschaften von Enzymen:
1) Effizienz. Eine kleine Menge des Katalysators ausreicht , um die chemische Reaktion von 10 6 Mal zu beschleunigen.

2) Spezifität auf. Ein Enzym ist nicht universell Katalysator einer Reaktion in der Zelle. Für Enzym Spezifität der Wirkung ausgedrückt: Jedes Enzym katalysiert nur eine oder mehrere gleichartige Reaktionen mit Substraten (die Edukteinspeisung), aber auch andere chemische Reagenzien für die gleiche Art kann das Enzym nutzlos. Interaktion mit den entsprechenden Substraten und der weiteren Beschleunigung der Reaktion ein aktives Zentrum des Enzyms.
3) Löschen Tätigkeit. Die Enzymaktivität in der Zelle ändert sich ständig von niedrig bis hoch.
4) Konzentration bestimmter Enzyme in der Zelle ist nicht konstant und kann in Abhängigkeit von den äußeren Bedingungen variiert. Solche Enzyme in der Biologie genannt induzierbare.
Klassifizierung von Enzymen
In ihrem Aufbau können die Enzyme in einfache und komplexe unterteilt werden. Einfach besteht ausschließlich aus den Aminosäureresten, sind komplexe Nicht-Protein-Gruppe von Substanzen. Komplex genannt Coenzyme.
Nach Art der Enzym-katalysierten Reaktionen sind unterteilt in:
1) Oxidoreduktasen (Redox-Reaktionen katalysieren).
2) Transferasen (übertragen an separate Gruppen von Atomen).
3) Lyasen (cleave chemische Bindungen).
4) Lipase (Verbindungsform in den Reaktionen durch die Energie der ATP).
5) Isomerasen (uchuvstvuyut Reaktionen gegenseitige Umwandlung der Isomere).
6) Hydrolases (katalysieren chemische Reaktionen durch Verdau mit Bindungen).
Struktur Enzym
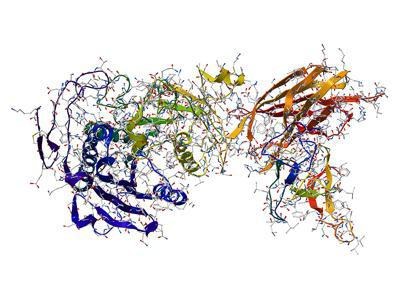
Enzyme – eine komplexe dreidimensionale Struktur, die im Wesentlichen der Aminosäurereste zusammengesetzt ist. Auch gibt es eine prosthetische Gruppe – eine Komponente der Nicht-Protein-Natur, die mit den Aminosäureresten.
Enzyme – hauptsächlich kugelförmige Proteine, die in komplexen Systemen kombiniert werden können. Wie bei anderen proteinartigen Substanzen, denaturiert werden Enzyme durch Erhöhung der Temperatur oder durch Exposition gegenüber einigen Chemikalien. Während Denaturierung variiert Tertiärstruktur Enzym und somit die Eigenschaften des aktiven Zentrums der Enzyme. dramatisch Als Ergebnis verringert sich die Enzymaktivität.
Katalysierte Substrat ist in der Regel viel kleiner als das Enzym selbst. Das einfachste Enzym besteht aus sechzig Aminosäureresten, und sein aktives Zentrum – nur zwei.
Es sind Enzyme katalytische Stelle Aminosäuren, die nicht dargestellt sind, und eine organische prosthetische Gruppe oder (häufiger) anorganischen Ursprungs – Cofaktor.
Das Konzept des aktiven Zentrums
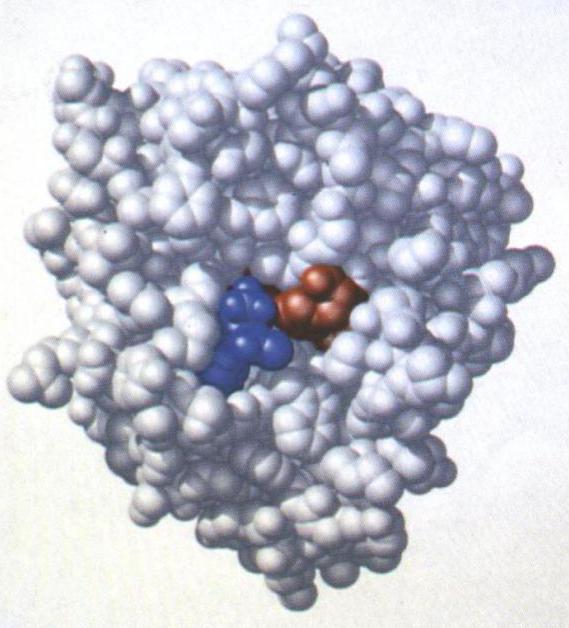
Nur ein kleiner Teil des Enzyms direkt an chemischen Reaktionen beteiligt. Dieser Teil des Enzyms namens das aktive Zentrum. Die aktive Stelle des Enzyms, – ein Lipid, ein wenige Aminosäurereste oder prosthetische Gruppe, die an ein Substrat bindet und katalysiert die Reaktion. Die Aminosäurereste des aktiven Zentrums können auf beliebige Aminosäuren gehören – polar, nicht-polaren, geladenen, aromatische ungeladen.
Das aktive Enzym Zentrum (das Lipid, Aminosäuren und andere Substanzen, die mit den Reagenzien reagieren) – ist der wichtigste Teil des Enzyms, ohne diese Substanzen wäre nutzlos.
Typischerweise weist das Enzymmolekül nur eine aktive Stelle, mit einem oder mehreren ähnlichen Reagenzien binden. Die Aminosäurereste des aktiven Zentrums gebildet Wasserstoff, hydrophobe oder kovalente Bindungen, die einen Enzym-Substrat-Komplex zu bilden.
Die Struktur des aktiven Zentrums
Die aktive Stelle von Enzymen, einfach und komplex ist eine Tasche oder einen Schlitz. Diese Struktur des aktiven Zentrums des Enzyms muss geometrisch Übereinstimmen und das Substrat elektrostatisch, da eine Änderung in der Tertiärstruktur des Enzyms mit der aktiven Stelle verändern können.
Bindungs- und katalytische Zentrum – Bereiche des aktiven Zentrums des Enzyms. Offensichtlich ist die Bindungsstelle „checks“ Substratkompatibilität und ist mit ihm verbunden, und das katalytische Zentrum direkt an der Reaktion beteiligt.
Die Bindung des aktiven Zentrums des Substrats
Um wie das aktive Zentrum des Enzyms mit einem bestimmten Reagenz, mehrere Theorien vorgeschlagen worden, im Zusammenhang zu erklären. Die beliebtesten von ihnen – Fishers Theorie, es ist die Theorie der „Schlüssel-Schloss“. Fisher vorgeschlagen, dass es ein Enzym ist ideal für jedes Substrat in seinen physikalischen und chemischen Eigenschaften geeignet. Nach der Bildung der Umstellungen nicht Enzym-Substrat-Komplex auftritt.
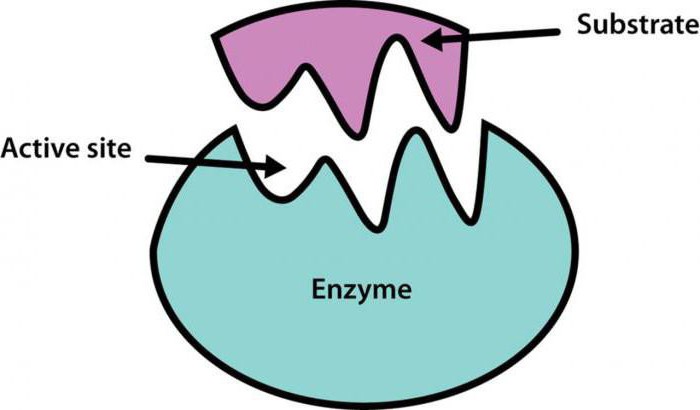
Ein anderer amerikanischer Gelehrter – Daniel Koshland – fügte Fisher Annahme der Theorie, dass die aktive Stelle des Enzyms ihre Konformation ändern können, solange kein spezielles Substrat passt.
Die Kinetik der enzymatischen Reaktionen
Eigenschaften enzymatische Reaktion studiert Biochemie des privaten Sektors – Enzymkinetik. Diese besondere Wissenschaft Untersuchungen der Reaktionen mit unterschiedlichen Konzentrationen an Enzymen und Substraten, die Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur innerhalb der Zelle und die Eigenschaften der aktiven Stelle von Enzymen auf den physikalischen und chemischen Parametern des Mediums abhängig.
Enzymkinetik arbeitet Konzepte wie Reaktionsgeschwindigkeit, Aktivierungsenergie, Aktivierungsbarriere, molecular Aktivität, spezifische Aktivität und andere. Einige dieser Konzepte in Betracht.
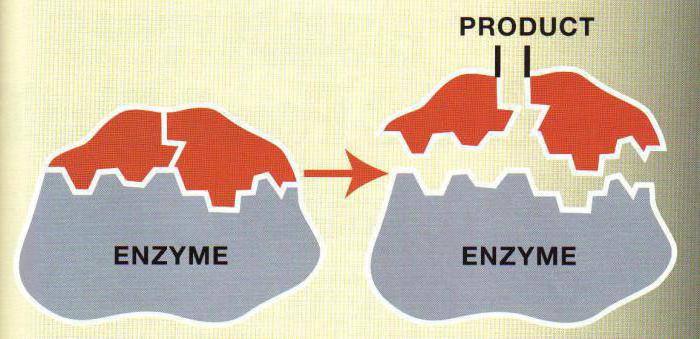
Dass es eine biologische Reaktion, war die Reagenzien notwendig, um etwas Energie zu übertragen. Diese Energie wird die Aktivierungsenergie genannt.
Die Zugabe des Enzyms zu den Reaktanden zu reduzieren , die Aktivierungsenergie. Einige Substanzen reagieren auf ohne Beteiligung von Enzymen, da die Aktivierungsenergie zu hoch ist. Das Reaktionsgleichgewicht verschiebt sich nicht mit der Zugabe des Enzyms.
Die Reaktionsgeschwindigkeit – die Menge an Reaktionsprodukt erschien oder in der Einheitszeit verschwunden.
Die Abhängigkeit der Reaktionsgeschwindigkeit von der Substratkonzentration dimensionslose physikalische Größe charakterisiert – Michaelis-Konstante.
Molekulare Aktivität – die Anzahl von Substratmolekülen, die auf ein Molekül des Enzyms pro Zeiteinheit umgewandelt werden.














