Konzentration und Dichte der Schwefelsäure. Abhängigkeit der Schwefelsäure-Dichte auf die Konzentration in der Autobatterie
Verdünnte und konzentrierte Schwefelsäure sind so wichtige chemische Produkte, die in der Welt mehr als alle anderen Stoffe produziert werden. Der ökonomische Reichtum eines Landes kann durch das Volumen der in ihm erzeugten Schwefelsäure geschätzt werden.
Der Prozess der Dissoziation
Schwefelsäure wird in Form von wässrigen Lösungen verschiedener Konzentrationen eingesetzt. Es unterliegt einer Dissoziationsreaktion in zwei Stufen, wodurch H + -Ionen in Lösung entstehen.
H & sub2; SO & sub4; = H & spplus; + HSO & sub4; – ;
HSO 4 – = H + + SO 4 -2 .
Schwefelsäure ist stark, und die erste Stufe ihrer Dissoziation ist so intensiv, dass fast alle Elternmoleküle in H + -Ionen und HSO 4 -1- Ionen (Hydrogensulfat) in der Lösung zerfallen. Die letzteren zersetzen sich teilweise weiter, geben ein weiteres H + -Ion frei und verlassen das Sulfation (SO 4 -2 ) in Lösung. Allerdings herrscht noch Wasserstoffsulfat, das eine schwache Säure ist, in Lösung über H + und SO 4 -2 . Eine vollständige Dissoziation erfolgt nur dann, wenn die Dichte der Schwefelsäurelösung sich der Dichte des Wassers nähert , d.h. unter starker Verdünnung. 
Eigenschaften von Schwefelsäure
Es ist besonders in dem Sinne, dass es je nach Temperatur und Konzentration als normale Säure oder als starkes Oxidationsmittel fungieren kann. Eine kalte verdünnte Lösung von Schwefelsäure reagiert mit den aktiven Metallen, um ein Salz (Sulfat) und die Entwicklung eines Wasserstoffgases zu erzeugen. Zum Beispiel sieht die Reaktion zwischen kalt verdünntem H 2 SO 4 (unter der Annahme seiner vollständigen zweistufigen Dissoziation) und metallischen Zink so aus:
Zn + H & sub2; SO & sub4; = ZnSO & sub4; + H & sub2 ;.
Heiße Schwefelsäure konzentriert, deren Dichte etwa 1,8 g / cm 3 beträgt, kann als Oxidationsmittel wirken und reagiert mit Materialien, die üblicherweise gegenüber Säuren inert sind, wie z. B. metallisches Kupfer. Während der Reaktion wird Kupfer oxidiert und die Säuremasse abnimmt, eine Kupfer (II) sulfatlösung in Wasser und Schwefeldioxid (SO 2 ) anstelle von Wasserstoff gebildet, was zu erwarten wäre, wenn die Säure mit dem Metall reagiert.
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O. 
Wie funktioniert die Konzentration der Lösungen
Tatsächlich kann die Konzentration jeder Lösung auf verschiedene Weisen ausgedrückt werden, aber am weitesten verbreitet ist die Gewichtskonzentration. Es zeigt die Anzahl der Gramm des gelösten Stoffes in einer bestimmten Masse oder einem Volumen einer Lösung oder eines Lösungsmittels (typischerweise 1000 g, 1000 cc, 100 cc und 1 dm 3 ). Anstelle der Masse der Substanz in Gramm kann man seine Menge, ausgedrückt in Mol, annehmen, so erhält man eine molare Konzentration pro 1000 g oder 1 dm 3 Lösung.
Wird die molare Konzentration in bezug auf die Menge der Lösung, sondern nur auf das Lösungsmittel bestimmt, so heißt sie die Molalität der Lösung. Es zeichnet sich durch Temperaturunabhängigkeit aus.
Oft ist die Gewichtskonzentration in Gramm pro 100 g Lösungsmittel angegeben. Multiplizieren Sie diese Zahl um 100%, erhalten Sie es in Gewichtsprozent (prozentuale Konzentration). Es ist diese Methode, die am häufigsten bei der Anwendung auf Lösungen von Schwefelsäure verwendet wird.
Jeder Wert der Konzentration der Lösung, bestimmt bei einer gegebenen Temperatur, entspricht einer sehr spezifischen Dichte (z. B. der Dichte einer Lösung von Schwefelsäure). Daher ist die Lösung manchmal dadurch gekennzeichnet. Beispielsweise hat eine Lösung von H 2 SO 4 , gekennzeichnet durch eine prozentuale Konzentration von 95,72%, eine Dichte von 1,835 g / cm 3 bei t = 20 ° C. Wie kann man die Konzentration einer solchen Lösung bestimmen, wenn nur die Dichte der Schwefelsäure gegeben ist? Ein Tisch, der eine solche Korrespondenz gibt, ist ein integraler Bestandteil jedes Lehrbuchs über die allgemeine oder analytische Chemie.
Konvertierungs-Neuberechnungsbeispiel
Lassen Sie uns versuchen, sich von einer Möglichkeit zu bewegen, die Konzentration der Lösung auf eine andere auszudrücken. Angenommen, wir haben eine Lösung von H 2 SO 4 In Wasser mit einer prozentualen Konzentration von 60%. Zuerst die geeignete Dichte der Schwefelsäure bestimmen. Eine Tabelle, die Prozentsätze (die erste Säule) und die entsprechenden Dichten einer wässrigen Lösung von H & sub2; SO & sub4; (vierte Säule) enthält, ist unten gezeigt. 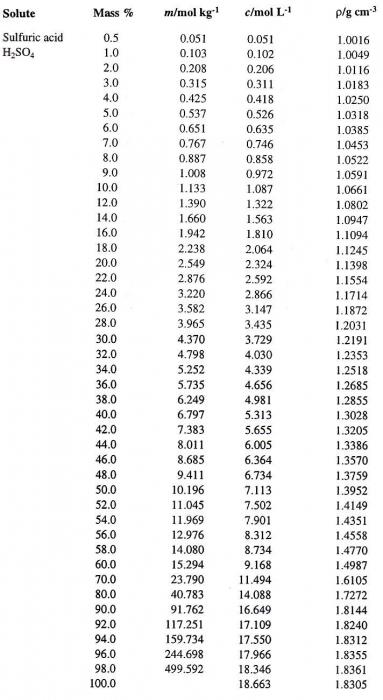
Darauf bestimmen wir den erforderlichen Wert, der gleich 1,4987 g / cm 3 ist . Wir berechnen nun die Molarität dieser Lösung. Hierzu ist es notwendig, die Masse von H 2 SO 4 zu bestimmen In 1 Liter Lösung und der entsprechenden Anzahl von Molen Säure.
Das Volumen, das 100 g der Stammlösung einnimmt:
100 / 1,4987 = 66,7 ml
Da in 66,7 Milliliter einer 60% igen Lösung 60 g Säure enthält, enthält sie in 1 Liter:
(60 / 66,7) x 1000 = 899, 55 g
Das Molgewicht der Schwefelsäure beträgt 98. Daher ist die Anzahl der in 899,55 Gramm enthaltenen Mole:
899,55 / 98 = 9,18 mol
Die Abhängigkeit der Schwefelsäuredichte von der Konzentration ist in Abb. 1 dargestellt. Unten. 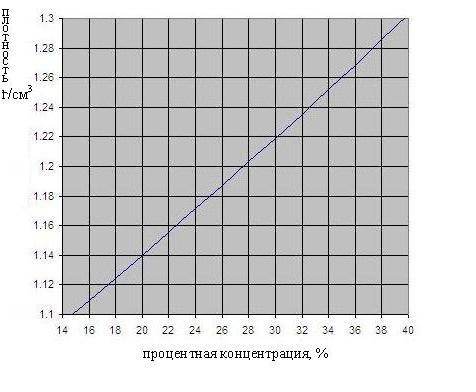
Verwendung von Schwefelsäure
Es wird in verschiedenen Branchen verwendet. Bei der Herstellung von Eisen und Stahl wird es verwendet, um die Metalloberfläche zu reinigen, bevor es mit einer anderen Substanz beschichtet wird, es beteiligt sich an der Herstellung von synthetischen Farbstoffen, sowie andere Arten von Säuren, wie Salzsäure und Salpetersäure. Es wird auch bei der Herstellung von Arzneimitteln, Düngemitteln und Sprengstoffen verwendet, und es ist auch ein wichtiges Reagenz bei der Beseitigung von Verunreinigungen aus Öl in der Ölraffinerien.
Diese Chemikalie ist im Alltag unglaublich nützlich und steht als Schwefelsäurelösung in Blei-Säure-Batterien (z. B. in Autos) zur Verfügung. Eine solche Säure hat im allgemeinen eine Konzentration von etwa 30% bis 35% H 2 SO 4 , wobei der Rest Wasser ist.
Für viele Haushaltsanwendungen werden 30% H 2 SO 4 mehr als genug sein, um ihre Bedürfnisse zu erfüllen. Allerdings ist in der Industrie eine viel höhere Konzentration an Schwefelsäure erforderlich. In der Regel wird es im Herstellungsverfahren erstmals ausreichend verdünnt und mit organischen Einschlüssen verunreinigt. Konzentrierte Säure wird in zwei Stufen gewonnen: Zuerst wird sie auf 70% gebracht und dann – in der zweiten Stufe – auf 96-98% angehoben, was der limitierende Indikator für eine wirtschaftlich rentable Produktion ist.
Die Dichte der Schwefelsäure und ihrer Sorten
Obwohl fast 99% Schwefelsäure kurz beim Kochen erhalten werden kann, führt der nachfolgende Verlust von SO 3 zum Siedepunkt zu einer Abnahme der Konzentration auf 98,3%. Im Allgemeinen ist die Sorte mit einem Indikator von 98% stabiler in der Lagerung.
Commodity Sorten von Sorten unterscheiden sich in ihrer prozentualen Konzentration, und für sie sind diejenigen Werte ausgewählt, für die die Kristallisationstemperaturen minimal sind. Dies geschieht, um den Niederschlag von Kristallen von Schwefelsäure im Sediment während des Transports und der Lagerung zu reduzieren. Die wichtigsten Sorten sind:
- Turm (Nitrosis) – 75%. Die Dichte der Schwefelsäure in dieser Klasse beträgt 1670 kg / m 3 . Holen Sie es so genannt. Nitroses-Verfahren, bei dem das bei der Abfeuerung des Primärrohstoffs erhaltene brennende Gas, das Schwefeldioxid SO 2 enthält , mit Nitrosen behandelt wird (dies ist auch H 2 SO 4 , aber mit darin gelösten Stickoxiden) in den gezeichneten Türmen (daher der Name der Sorte). Als Ergebnis werden Säure- und Stickoxide freigesetzt, die im Prozess nicht verbraucht werden, sondern in den Produktionszyklus zurückkehren.
- Kontakt – 92,5-98,0%. Die Schwefelsäuredichte von 98% dieser Sorte beträgt 1836,5 kg / m3. Es wird auch aus einem kalzinierten Gas erhalten, das SO 2 enthält , wobei das Verfahren das Oxidieren des Dioxids zu einem SO 3 -Anhydrid bei Kontakt (daher den Namen der Sorte) mit mehreren Schichten eines festen Vanadiumkatalysators umfasst.
- Oleum – 104,5%. Seine Dichte entspricht 1896,8 kg / m 3 . Diese Lösung von SO 3 in H 2 SO 4 , in der die erste Komponente 20% und die Säuren enthält, beträgt 104,5%.
- Hochzins-Oleum – 114,6% . Seine Dichte beträgt 2002 kg / m 3 .
- Wiederaufladbar – 92-94%.
Wie ist die Autobatterie
Die Arbeit dieser einen der massivsten elektrotechnischen Vorrichtungen beruht vollständig auf elektrochemischen Prozessen, die in Gegenwart einer wässrigen Schwefelsäurelösung auftreten.
Die Autobatterie enthält verdünnten Schwefelsäure-Elektrolyt sowie positive und negative Elektroden in Form mehrerer Platten. Positive Platten bestehen aus rötlich-braunem Material – Bleidioxid (PbO 2 ), und negative sind aus grauem "schwammigem" Blei (Pb).
Da die Elektroden aus Blei oder Blei-haltigem Material bestehen, wird diese Art von Batterie oft als Blei-Säure-Batterie bezeichnet. Sein Wirkungsgrad, dh die Größe der Ausgangsspannung, wird direkt durch die Stromdichte der Schwefelsäure (kg / m3 oder g / cm3) bestimmt, die in der Batterie als Elektrolyt gefüllt ist.
Was passiert mit dem Elektrolyten, wenn die Batterie entladen ist?
Der Elektrolyt der Blei-Säure-Batterie ist eine Lösung von Speicher-Schwefelsäure in chemisch reinem destilliertem Wasser mit einer prozentualen Konzentration von 30%, wenn er vollständig geladen ist. Die reine Säure hat eine Dichte von 1,835 g / cm 3 , der Elektrolyt beträgt etwa 1.300 g / cm 3 . Wenn die Batterie entladen wird, treten hier elektrochemische Reaktionen auf, wodurch Schwefelsäure aus dem Elektrolyten entnommen wird. Die Dichte der Lösungskonzentration hängt nahezu proportional ab, so dass sie aufgrund einer Abnahme der Elektrolytkonzentration abnehmen sollte.
Solange der Entladestrom durch die Batterie fließt, wird die Säure nahe ihren Elektroden aktiv verwendet und der Elektrolyt wird verdünnt. Die Diffusion von Säure aus dem Volumen des gesamten Elektrolyten und zu den Elektrodenplatten behält eine annähernd konstante Intensität der chemischen Reaktionen und infolgedessen die Ausgangsspannung bei.
Zu Beginn des Entladungsprozesses tritt die Säurediffusion vom Elektrolyten zu den Platten schnell auf, weil das so gebildete Sulfat die Poren noch nicht im aktiven Material der Elektroden blockiert. Wenn Sulfat beginnt, die Poren der Elektroden zu bilden und zu füllen, tritt die Diffusion langsamer auf.
Theoretisch können Sie die Entladung fortsetzen, bis alle Säure verwendet wird, und der Elektrolyt besteht aus reinem Wasser. Die Erfahrung zeigt jedoch, dass die Entladungen nicht fortgesetzt werden sollten, nachdem die Dichte des Elektrolyten auf 1.150 g / cm 3 gefallen ist.
Wenn die Dichte von 1300 auf 1.150 fällt, bedeutet dies, daß während der Reaktionen so viel Sulfat gebildet wurde, und es füllt alle Poren in den aktiven Materialien auf den Platten, das heißt, fast die ganze Schwefelsäure ist bereits aus der Lösung entfernt worden. Die Dichte hängt von der Konzentration ab, und die Ladung hängt von der Dichte ab. In Fig. Die Abhängigkeit der Ladung der Batterie von der Dichte des Elektrolyten ist nachfolgend dargestellt. 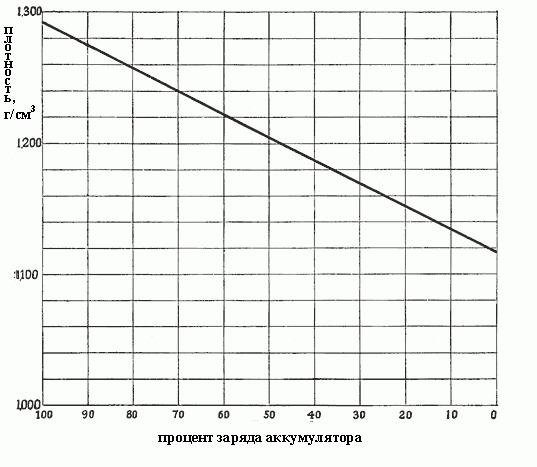
Das Ändern der Dichte des Elektrolyts ist der beste Weg, um den Zustand der Entladung der Batterie zu bestimmen, vorausgesetzt, dass es richtig verwendet wird.
Entladungsgrade einer Autobatterie in Abhängigkeit von der Dichte des Elektrolyten
Seine Dichte sollte alle zwei Wochen gemessen werden und eine Aufzeichnung der Messwerte sollte für zukünftige Verwendung aufbewahrt werden.
Je dichter der Elektrolyt, desto mehr Säure enthält er, und je mehr die Batterie aufgeladen wird. Die Dichte von 1.300-1.280 g / cm 3 gibt die Gesamtladung an. In der Regel unterscheiden sich die folgenden Entladungsgrade der Batterie je nach Dichte des Elektrolyts:
- 1.300-1.280 – voll aufgeladen:
- 1.280-1.200 – mehr als die Hälfte entlassen;
- 1.200-1.150 – weniger als halb aufgeladen;
- 1.150 – praktisch entlassen.
Für eine voll aufgeladene Batterie, vor dem Anschluss des Fahrzeugnetzes, beträgt die Spannung jeder Zelle 2,5 bis 2,7 V. Sobald die Last angeschlossen ist, fällt die Spannung für drei oder vier Minuten schnell auf ca. 2,1 V ab. Dies ist auf die Bildung einer dünnen Schicht aus Bleisulfat auf der Oberfläche der negativen Elektrodenplatten und zwischen der Schicht aus Bleiperoxid und dem Metall der positiven Platten zurückzuführen. Der Endwert der Zellenspannung nach Anschluss an das Automobilnetz beträgt etwa 2,15-2,18 Volt.
Wenn der Strom während der ersten Betriebsstunde durch die Batterie fließt, tritt ein Spannungsabfall von bis zu 2 V aufgrund der Zunahme des Innenwiderstandes der Zellen aufgrund der Bildung einer größeren Menge an Sulfat, die die Poren der Platten füllt, und die Entfernung von Säure aus dem Elektrolyten auf. Kurz bevor der Strom fließt , ist die Dichte des Elektrolyten maximal und gleich 1.300 g / cm 3 . Anfänglich tritt seine Verdünnung schnell auf, aber dann wird ein ausgeglichener Zustand zwischen der Säuredichte in der Nähe der Platten und im Hauptvolumen des Elektrolyten festgestellt, die Säureextraktion durch Elektroden wird durch die Ankunft neuer Säureteile vom Hauptteil des Elektrolyten unterstützt. Gleichzeitig sinkt die mittlere Dichte des Elektrolyts stetig entsprechend der in Fig. 1 gezeigten Abhängigkeit. Höher. Nach dem anfänglichen Tropfen nimmt die Spannung langsamer ab, die Rate der Abnahme hängt von der Belastung der Batterie ab. Der Zeitdiagramm des Entladungsprozesses ist in Fig. 1 gezeigt. Unten. 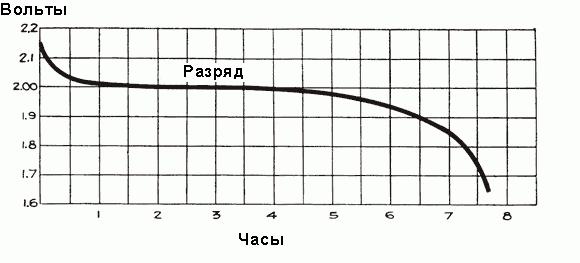
Überwachung des Elektrolyten in der Batterie
Zur Bestimmung der Dichte wird ein Dichtemesser verwendet. Es besteht aus einem kleinen versiegelten Glasrohr mit einer Verlängerung am unteren Ende, mit Schuss oder Quecksilber gefüllt, und eine Skala am oberen Ende. Diese Skala ist von 1.100 bis 1.300 mit unterschiedlichen Zwischenwerten markiert, wie in Abb. Unten. Wenn dieses Hydrometer in den Elektrolyten gelegt wird, wird es auf eine bestimmte Tiefe fallen. In diesem Fall wird es ein bestimmtes Elektrolytvolumen verschieben, und wenn die Gleichgewichtsposition erreicht ist, wird das Gewicht des verdrängten Volumens einfach gleich dem Gewicht des Hydrometers sein. Da die Dichte des Elektrolyten gleich dem Verhältnis von Gewicht zu Volumen ist und das Gewicht des Hydrometers bekannt ist, entspricht jeder Grad seines Eintauchens in der Lösung einer bestimmten Dichte. 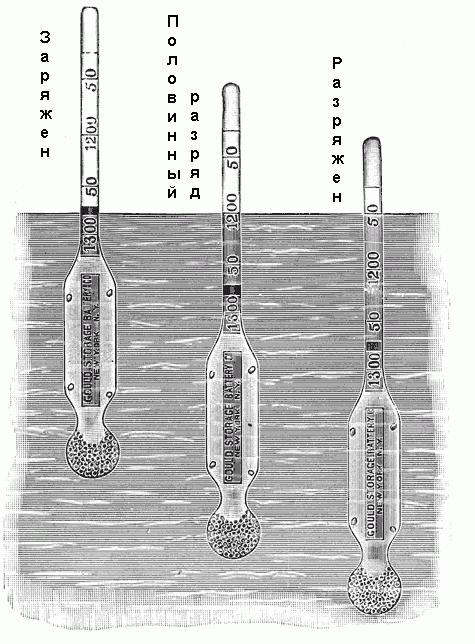 Einige Isometer haben keine Skala mit Dichtewerten, sondern sind mit "Charged", "Half Entladung", "Full Entladung" oder ähnlichem gekennzeichnet.
Einige Isometer haben keine Skala mit Dichtewerten, sondern sind mit "Charged", "Half Entladung", "Full Entladung" oder ähnlichem gekennzeichnet.