Ozon ist ein Gas aus blauer Farbe. Eigenschaften und Anwendung von Gas. Ozon in der Atmosphäre
Ozon ist ein Gas. Im Gegensatz zu vielen anderen ist es nicht transparent, hat aber eine charakteristische Farbe und sogar einen Geruch. Es ist in unserer Atmosphäre präsent und gehört zu den wichtigsten Komponenten. Was ist die Dichte von Ozon, seine Masse und andere Eigenschaften? Was ist seine Rolle im Leben des Planeten?
Blaues Gas
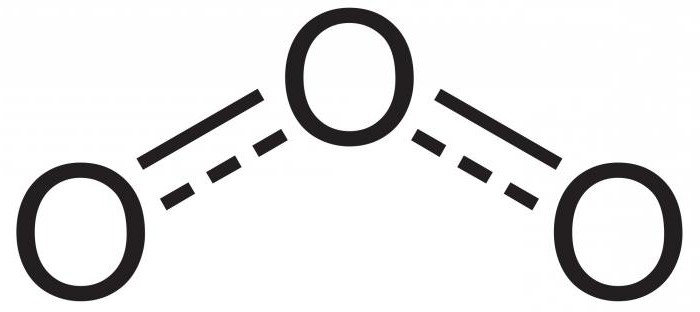
In der Chemie hat Ozon keinen separaten Platz im Periodensystem. Alles weil er kein Element ist. Ozon ist eine allotrope Veränderung oder eine Variation von Sauerstoff. Wie in O2 besteht sein Molekül nur aus Sauerstoffatomen, aber es hat nicht zwei, sondern drei. Deshalb sieht seine chemische Formel wie O3 aus.
Ozon ist ein Gas aus blauer Farbe. Es hat einen spürbaren scharfen Geruch, der Chlor ähnelt, wenn die Konzentration zu hoch ist. Erinnerst du dich an den Geruch von Frische im Regen? Das ist Ozon. Dank dieser Eigenschaft bekam es seinen Namen, denn aus der altgriechischen Sprache "Ozon" – es "riecht".
Das Gasmolekül ist polar, die Atome in ihm sind unter einem Winkel von 116,78 ° verbunden. Ozon wird gebildet, wenn ein freies Sauerstoffatom dem O2-Molekül zugesetzt wird. Dies geschieht bei verschiedenen Reaktionen, z. B. Oxidation von Phosphor, elektrischer Entladung oder Zersetzung von Peroxiden, bei denen Sauerstoffatome freigesetzt werden.
Eigenschaften von Ozon
Unter normalen Bedingungen existiert Ozon als Gas mit einem Molekulargewicht von fast 48 g / mol. Es ist ein Diamant, das heißt, es kann nicht zu einem Magneten, wie Silber, Gold oder Stickstoff anziehen. Die Ozondichte beträgt 2,1445 g / dm3.
Im festen Zustand erwirbt Ozon eine blau-schwarze Farbe, in flüssigem Zustand ist es indigo, nah an lila. Der Siedepunkt beträgt 111,8 Grad Celsius. Bei einer Temperatur von null Grad löst es sich in Wasser (nur in reinem Wasser) zehnmal besser als Sauerstoff. Es vermischt sich perfekt mit flüssigem Methan, Stickstoff, Fluor, Argon und unter bestimmten Bedingungen mit Sauerstoff.

Unter der Wirkung einer Anzahl von Katalysatoren ist es leicht zu oxidieren und freisetzt freie Sauerstoffatome. Verbinden mit ihm, sofort entzündet. Die Substanz kann fast alle Metalle oxidieren. Nur Platin und Gold eignen sich nicht für seine Handlung. Es zerstört verschiedene organische und aromatische Verbindungen. Bei Kontakt mit Ammoniak bildet es Ammoniumnitrit, zerstört die Doppelkohlenstoffbindungen.
In der Atmosphäre in hohen Konzentrationen präsentiert sich Ozon spontan zersetzt. In diesem Fall wird Wärme freigesetzt und ein Molekül O2 gebildet. Je höher die Konzentration, desto stärker ist die Wärmefreisetzungsreaktion. Bei einem Ozongehalt von mehr als 10% wird eine Explosion begleitet. Mit zunehmender Temperatur und abnehmendem Druck oder Kontakt mit organischen Substanzen ist die Zersetzung von O3 schneller.
Geschichte der Entdeckung
In der Chemie war Ozon bis zum 18. Jahrhundert nicht bekannt. Es wurde im Jahre 1785 entdeckt, dank des Geruchs, dass der Physiker Van Marum neben der elektrostatischen Maschine hörte. Noch 50 Jahre danach erschien kein Gas in wissenschaftlichen Experimenten und Forschung.
Wissenschaftler Christian Schoenbane im Jahre 1840 untersuchte die Oxidation von weißem Phosphor. Während der Experimente gelang es ihm, eine unbekannte Substanz zu identifizieren, die er "Ozon" nannte. Der Chemiker nahm das Studium seiner Eigenschaften auf und beschrieb Wege, um neu entdecktes Gas zu erhalten.
Bald haben sich andere Wissenschaftler der Forschung der Substanz angeschlossen. Der berühmte Physiker Nikola Tesla baute sogar den ersten Ozongenerator. Die industrielle Nutzung von O3 begann am Ende des XIX Jahrhunderts mit dem Aufkommen der ersten Installationen für die Versorgung von Trinkwasser zu Hause. Die Substanz wurde zur Desinfektion verwendet.

Ozon in der Atmosphäre
Unsere Erde ist von einer unsichtbaren Schale umgeben von der Luft – die Atmosphäre. Ohne sie wäre das Leben auf dem Planeten unmöglich. Umgebungsluftkomponenten: Sauerstoff, Ozon, Stickstoff, Wasserstoff, Methan und andere Gase.
Ozon selbst existiert nicht und tritt nur als Folge chemischer Reaktionen auf. In der Nähe der Oberfläche der Erde, ist es durch elektrische Einleitungen von Blitz während eines Gewitters gebildet. Unnatürliche Weise scheint es durch Emissionen von Autoabgasen, Pflanzen, Dämpfen von Benzin, den Betrieb von thermischen Kraftwerken.

Ozon der unteren Schichten der Atmosphäre heißt Oberfläche oder troposphärisch. Es gibt auch eine stratosphärische. Es entsteht unter der Wirkung der ultravioletten Strahlung, die von der Sonne kommt. Es ist in einer Entfernung von 19-20 Kilometern über der Oberfläche des Planeten gebildet und erstreckt sich auf eine Höhe von 25-30 Kilometern.
Stratosphärisches O3 bildet die Ozonschicht des Planeten, die es vor starker Sonneneinstrahlung schützt. Es absorbiert etwa 98% der ultravioletten Strahlung mit einer Wellenlänge, die für den Beginn von Krebs und Verbrennungen ausreichend ist.
Anwendung des Stoffes
Ozon ist ein ausgezeichnetes Oxidationsmittel und Zerstörer. Diese Eigenschaft wurde seit langem verwendet, um Trinkwasser zu reinigen. Die Substanz hat eine schädliche Wirkung auf gefährliche Bakterien und Viren für den Menschen und selbst wird bei der Oxidation zu harmlosem Sauerstoff.
Es ist in der Lage, sogar organismen, die resistent gegen Chlor sind, zu töten. Darüber hinaus wird es verwendet, um Abwasser von umweltschädlichen Erdölprodukten, Sulfiden, Phenolen usw. zu reinigen. Solche Praktiken sind vor allem in den USA und einigen europäischen Ländern vorherrschend.
Ozon wird in der Medizin verwendet, um Werkzeuge zu desinfizieren, in der Industrie mit ihrer Hilfe, Bleichmittel Papier, saubere Öle, bekommen verschiedene Substanzen. Die Verwendung von O3 zur Reinigung von Luft, Wasser und Raum wird als Ozonation bezeichnet.

Ozon und Mann
Trotz all seiner nützlichen Eigenschaften kann Ozon für den Menschen gefährlich sein. Wenn es mehr Gas in der Luft gibt, als eine Person tolerieren kann, kann eine Vergiftung nicht vermieden werden. In Russland ist die zulässige Norm 0,1 μg / l.
Wenn diese Grenze überschritten wird, treten typische Anzeichen einer chemischen Vergiftung auf, wie Kopfschmerzen, Reizung der Schleimhäute, Schwindel. Ozon reduziert die Resistenz des Körpers gegenüber Infektionen, die durch die Atemwege übertragen werden, und reduziert auch den Blutdruck. Wenn die Gaskonzentration über 8-9 μg / l liegt, sind Lungenödem und sogar Tod möglich.
In diesem Fall ist es ganz einfach, Ozon in der Luft zu erkennen. Der Geruch von "Frische", Chlor oder "Krebse" (wie Mendeleev behauptet) ist auch bei geringem Materie deutlich hörbar.